
【題目】莫爾鹽的化學式為( NH4)2Fe(SO4)2·6H2O,溶于水而不溶于乙醇,常被用作氧化還原滴定的基準物。下面是制取莫爾鹽的部分裝置與實驗步驟:

①將鐵屑放入小燒杯中,加適量的Na2CO3溶液,小火加熱幾分鐘,倒掉溶液后,用蒸餾水洗凈鐵屑,晾干。
②在錐形瓶中加入2.24 g 鐵屑和少量碳粉,由分液漏斗滴加20 mL 3 mol/L硫酸溶液。
③待反應結束后,由分液漏斗加入適量的(NH4)2SO4溶液,過濾。在濾液中加入一定量的乙醇,待晶體析出后,過濾、洗滌、晾干,得莫爾鹽晶體。
請回答下列問題:
(1)實驗開始前,檢查反應器氣密性的方法為_____________________。
(2)步驟①中Na2CO3溶液的作用是_____________________________________。
(3)步驟②中滴加硫酸溶液時留取少許溶液于分液漏斗中的原因是__________________,加入少量碳粉的作用是_________________________________________。
(4)步驟③中理論上需加入2 mol/L 的(NH4)2SO4溶液______________mL。
(5)取10.00 g鉻青銅樣品,將其中的鉻氧化為H2CrO4,再加入硫酸酸化,并配成250mL溶液,取出25.00 mL用濃度為0.0180 mol/L的(NH4)2Fe(SO4)2標準溶液滴定,終點時用去標準液20.75 mL。已知弱酸H2CrO4被還原為Cr3+,則滴定時反應的離子方程式為_____________________________________。該樣品中鉻元素的質量分數為______。
【答案】 關閉止水夾,打開分液漏斗活塞向錐形瓶中滴加水,若一段時間后水不能滴下來,則反應器氣密性良好。(或:關閉分液漏斗活塞,打開止水夾,將導管口置于水槽中液面下,微熱錐形瓶,若導管口有氣泡產生,停止加熱一段時間后,管口倒吸形成一段水柱,則反應器氣密性良好。) 除去鐵屑表面的油污 起液封作用,(防止Fe2+被氧化) 與鐵、稀硫酸構成原電池,加快反應速率 20 H2CrO4+3Fe2++6H+=Cr3++3Fe3++4H2O 0.65或65%
【解析】(1)實驗開始前,檢查反應器氣密性的方法為:關閉止水夾,打開分液漏斗活塞向錐形瓶中滴加水,若一段時間后水不能滴下來,則反應器氣密性良好;(或:關閉分液漏斗活塞,打開止水夾,將導管口置于水槽中液面下,微熱錐形瓶,若導管口有氣泡產生,停止加熱一段時間后,管口倒吸形成一段水柱,則反應器氣密性良好);正確答案:關閉止水夾,打開分液漏斗活塞向錐形瓶中滴加水,若一段時間后水不能滴下來,則反應器氣密性良好。(或:關閉分液漏斗活塞,打開止水夾,將導管口置于水槽中液面下,微熱錐形瓶,若導管口有氣泡產生,停止加熱一段時間后,管口倒吸形成一段水柱,則反應器氣密性良好)。
(2)Na2CO3溶液水解顯堿性,能夠與油污發生反應,可以洗滌鐵粉中的油污;正確答案:除去鐵屑表面的油污。
(3)步驟②中滴加硫酸溶液時留取少許溶液于分液漏斗中,能夠起到液封作用,防止空氣把Fe2+氧化;鐵、碳和稀硫酸構成原電池,加快反應速率;正確答案:起液封作用,(防止Fe2+被氧化);與鐵、稀硫酸構成原電池,加快反應速率。
(4)2.24 g 鐵屑與20 mL 3 mol/L硫酸溶液反應,硫酸過量,消耗鐵的量為0.04mol,生成硫酸亞鐵的量為0.04 mol,然后根據(NH4)2SO4+FeSO4+6H2O =( NH4)2Fe(SO4)2·6H2O反應可知消耗n(NH4)2SO4)=0.04 mol, 根據c×V=n可知,0.04=2×V,V=0.02L=20 mL;正確答案:20。
(5)根據題給信息可知,H2CrO4能夠把(NH4)2Fe(SO4)2中的亞鐵離子氧化為鐵離子,本身還原為Cr3+,反應的離子方程式為H2CrO4+3Fe2++6H+=Cr3++3Fe3++4H2O; 根據反應關系:H2CrO4-3Fe2+可知:25.00 mL溶液中n((NH4)2Fe(SO4)2)=n(Fe2+)=0.018×20.75×10-3=3.735×10-4mol, n( H2CrO4)=1.245×10-4mol,則250mL溶液含有n( H2CrO4)=1.245×10-3 mol;m(Cr)= 1.245×10-3×52g; 該樣品中鉻元素的質量分數為1.245×10-3×52/10×100%=65%;正確答案:H2CrO4+3Fe2++6H+=Cr3++3Fe3++4H2O;65%或0.65


科目:高中化學 來源: 題型:
【題目】某新型有機酰胺化合物M在l業生產中有重要的作用,其合成路線如下:

已知:①A是烴的含氧衍生物,相對分子質量為58,碳和氫的質量分數之和為44.8%,核磁共振氫譜顯示為一組峰,可發生銀鏡反應。
②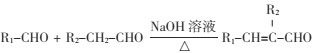
③![]()
④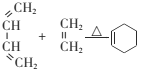
回答下列問題:
(1)E的結構簡式為 ___,G的名稱為_____
(2)B中含有官能團的名稱為_______。
(3)C-D的反應類型為 ___。
(4)寫出 F+H—M的化學反應方程式____。
(5)芳香族化合物W有三個取代基,是C的同分異構體,能與FeCl3溶液發生顯色反應。 0.5 molW可與足量的Na反應生成1gH2,H核磁共振氫譜顯示為五組峰,符合以上條件的W的同分異構體共有___ 種,寫出其中一種的結構簡式____。
(6)參照上述合成路線.以CH2=CH2和HOCH2CH2OH為原料(無機試劑任選),設計制備![]() 的合成路線________。
的合成路線________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗的操作不正確的是( )
A.分液時,分液漏斗內的上層液體應由上口倒出
B.用加熱分解的方法區分碳酸鈉和氯化鈉兩種固體
C.過濾氫氧化鈉溶液除去不溶性雜質時,需用玻璃棒引流
D.某溶液中加入硝酸酸化的硝酸銀溶液,產生白色沉淀,該溶液中含有氯離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電解質的說法正確的是( )
A.強電解質的溶液一定比弱電解質的溶液導電性強
B.強電解質的溶液中只有陰、陽離子
C.離子化合物都是強電解質,而弱電解質都是共價化合物
D.由于硫酸鋇難溶于水,所以是弱電解質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】O2和O3是氧元素的兩種單質,根據其分子式完成下列各題:
(1)等質量的O2和O3所含分子個數比為 , 原子個數比為 , 分子的物質的量之比為 .
(2)等溫等壓下,等體積的O2和O3所含分子個數比為 , 原子個數比為 , 質量比為 .
(3)設NA為阿伏伽德羅常數的數值,如果a g某氣體中含有的分子數為b,則c g該氣體在標準狀況下的體積約是 (用含NA的式子表示).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了除去粗鹽中的Ca2+、Mg2+、SO42-及泥沙,可將粗鹽溶于水,然后進行下列五項操作:①過濾,②加 過量NaOH溶液,③加適量鹽酸,④加過量Na2CO3溶液,⑤加過量BaCl2溶液。正確的操作順序是( )
A.②①④⑤③B.④②⑤①③C.②⑤④①③D.⑤②①④③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D四種物質之間有圖所示的轉化關系.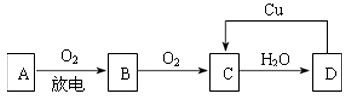
已知,A是空氣中的主要成分,B、C、D均為化合物,且C為紅棕色氣體.
請回答下列問題:
①寫出A和C的化學式:A , C .
②B→C觀察到的現象是 .
③C→D的化學反應方程式是 , 該反應的氧化劑是 , 還原劑是 .
④在圖示D→C的過程中發生反應的化學方程式是 , 其中,D表現出強(填“氧化性”或“還原性”).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】檸檬酸(用HR 表示)是一種高效除垢劑,現用一定濃度的檸檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量隨pH的變化如圖所示。下列說法正確的是
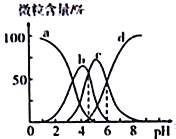
A. H3R的第二步電離常數Ka2(H3R)的數量級為10-4
B. pH=6時,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于電離程度
D. pH=4時,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com