
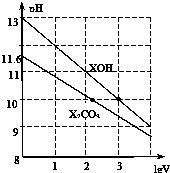
 體積為1ml、濃度均為0.10mol/L的XOH和X2CO3溶液分別加水稀釋至體積為V,pH隨lgV的變化情況如圖所示,下列敘述中正確的是( )
體積為1ml、濃度均為0.10mol/L的XOH和X2CO3溶液分別加水稀釋至體積為V,pH隨lgV的變化情況如圖所示,下列敘述中正確的是( )| A. | XOH是強堿 | |
| B. | pH=10的兩種溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的電離平衡常數Ka1遠遠大于Ka2,則Ka2約為1×10-10•2 | |
| D. | 當lgV=2時,若X2CO3溶液升高溫度,溶液堿性增強,則$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$減小 |
分析 A.根據圖知,0.1mol/L的XOH的pH=13,說明XOH溶液中c(OH-)=c(XOH);
B.XOH是強堿溶液、X2CO3是強堿弱酸鹽溶液,要使兩種溶液的pH相等,則c(XOH)<c(X2CO3),再結合物料守恒判斷;
C.0.10mol/LX2CO3溶液的pH=11.6,則該溶液中c(OH-)=c(HCO3-)=$\frac{1{0}^{-14}}{1{0}^{-11.6}}$mol/L=10-2.4 mol/L,c(CO32-)=0.1mol/L,Kh1=$\frac{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=,則Ka2=$\frac{{K}_{w}}{{K}_{h1}}$=$\frac{Kwc(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}$;
D.當lgV=2時,則溶液的體積變為原來的100倍,升高溫度,促進水解,第一步水解程度遠遠大于第二步,所以溶液中c(CO32-)減小,c(HCO3-)增大.
解答 解:A.根據圖知,0.1mol/L的XOH的pH=13,說明XOH溶液中c(OH-)=c(XOH),XOH完全電離,為強電解質,即為強堿,故A正確;
B.XOH是強堿溶液、X2CO3是強堿弱酸鹽溶液,要使兩種溶液的pH相等,則c(XOH)<c(X2CO3),再結合物料守恒得c(X+):XOH小于X2CO3,故B錯誤;
C.0.10mol/LX2CO3溶液的pH=11.6,則該溶液中c(OH-)=c(HCO3-)=$\frac{1{0}^{-14}}{1{0}^{-11.6}}$mol/L=10-2.4 mol/L,c(CO32-)=0.1mol/L,Kh1=$\frac{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=,則Ka2=$\frac{{K}_{w}}{{K}_{h1}}$=$\frac{Kwc(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}$=$\frac{1{0}^{-14}×0.1}{1{0}^{-2.4}×1{0}^{-2.4}}$=1.0×10-10.2,故C正確;
D.當lgV=2時,則溶液的體積變為原來的100倍,升高溫度,促進水解,第一步水解程度遠遠大于第二步,所以溶液中c(CO32-)減小,c(HCO3-)增大,所以$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$增大,故D錯誤;
故選AC.
點評 本題考查離子濃度大小比較,側重考查學生分析判斷及計算能力,為高頻考點,明確電離平衡常數與水解平衡常數的關系是解本題關鍵,注意:二元弱酸中存在Kh1.Ka2=Kw,為易錯點.


科目:高中化學 來源: 題型:選擇題
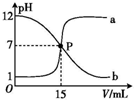 曲線 a 和 b 是常溫下鹽酸與氫氧化鈉溶液相互滴定的滴定曲線.下列敘述中正確的是( )
曲線 a 和 b 是常溫下鹽酸與氫氧化鈉溶液相互滴定的滴定曲線.下列敘述中正確的是( )| A. | 鹽酸的物質的量濃度與 NaOH 溶液的物質的量濃度相等 | |
| B. | P 點時溶液中 c(Na+)=c(Cl-)=c(H+)=c(OH-) | |
| C. | 曲線 a 是鹽酸滴定氫氧化鈉溶液的滴定曲線 | |
| D. | 曲線 b 中滴定前 NaOH 溶液的體積為 150 mL |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 23gNa在氧氣中完全燃燒失去NA個電子 | |
| B. | 常溫常壓下,6.2g Na2O含有的Na+離子數為0.2 NA | |
| C. | 標準狀況下,22.4LH2O含有NA個分子 | |
| D. | 1L0.5 mol/LFe2(SO4)3溶液中,SO42-的數目為1.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
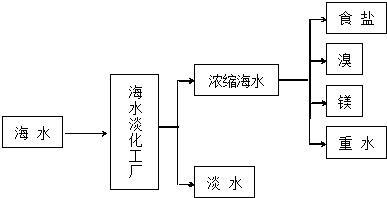
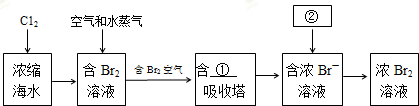
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
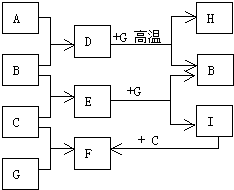 單質A、B、C在常溫下均為氣態,分別由甲、乙、丙三種短周期元素組成;丙元素的原子結構中次外層電子數比最外層電子數多1;G是常見的金屬單質,D在常溫下為液態,H是一種黑色晶體.各物質間的轉化關系如圖所示(反應條件多數已略去).
單質A、B、C在常溫下均為氣態,分別由甲、乙、丙三種短周期元素組成;丙元素的原子結構中次外層電子數比最外層電子數多1;G是常見的金屬單質,D在常溫下為液態,H是一種黑色晶體.各物質間的轉化關系如圖所示(反應條件多數已略去).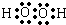 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com