
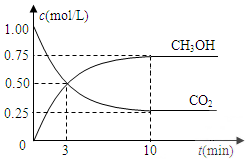
 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定條件下,向體積固定為1L的密閉容器中充入1mol CO2和3mol H2,測得CO2和CH3OH(g)的濃度隨時間變化曲線如圖所示.
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定條件下,向體積固定為1L的密閉容器中充入1mol CO2和3mol H2,測得CO2和CH3OH(g)的濃度隨時間變化曲線如圖所示.分析 (1)根據v=$\frac{△c}{△t}$計算;
(2)根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積計算;
(3)使n(CH3OH)/n(CO2)應采取措施,使平衡向正反應移動,注意不能增大二氧化碳或降低甲醇的量;
(4)a.平衡常數K是溫度的函數;
b.若向該密閉容器中再充入1mol CO2和3mol H2,相當于增大壓強,平衡正向移動,CO2的轉化率增大;
c.若向該密閉容器中再充入1mol CO2和3mol H2,相當于增大壓強,平衡正向移動,所以達平衡后c(CH3OH)比10分鐘時的2倍大;
d.不可能完全反應.
解答 解:(1)反應開始至第3分鐘內,氫氣的平均反應速率v(CO2)=$\frac{0.5mol/L}{3min}$=$\frac{1}{6}$mol•L-1•min-1,故答案為:$\frac{1}{6}$;
(2)利用三段式解題法計算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
開始(mol/L):1 3 0 0
變化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
K=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$,故答案為:$\frac{16}{3}$;
(3)使n(CH3OH)/n(CO2)應采取措施,使平衡向正反應移動,注意不能增大二氧化碳或降低甲醇的量,
a、該反應正反應是放熱反應,升高溫度平衡向逆反應移動,n(CH3OH)/n(CO2)減小,故a錯誤,
b、加入適當的催化劑,平衡不移動,故b錯誤;
c、將H2O(g)從體系中分離,平衡向正反應移動,n(CH3OH)/n(CO2)增大,故c正確;
d、充入He(g),使體系壓強增大,容器的容積不變,反應混合物的濃度不變,平衡不移動,n(CH3OH)/n(CO2)不變,故d錯誤;
故答案為:c;
(4)a.平衡常數K是溫度的函數,溫度不變平衡常數不變,故錯誤;
b.若向該密閉容器中再充入1mol CO2和3mol H2,相當于增大壓強,平衡正向移動,CO2的轉化率增大,故正確;
c.若向該密閉容器中再充入1mol CO2和3mol H2,相當于增大壓強,平衡正向移動,所以達平衡后c(CH3OH)比10分鐘時的2倍大,故錯誤;
d.不可能完全反應,所以不可能反應繼續放出熱能49kJ,故錯誤;故選b.
點評 本題考查反應速率計算、化學平衡的計算與影響因素、平衡常數等,難度中等,注意基礎知識的掌握,注意平衡移動應用.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 逸出SO3氣體 | B. | 逸出SO2氣體 | ||
| C. | 析出BaO3沉淀 | D. | 析出BaSO4沉淀和BaSO3沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈣和磷都是人體內含量豐富的礦物元素,它們都屬于微量元素 | |
| B. | 垃圾焚燒和發電技術的結合,既解決了污染問題,又有效利用了垃圾所含的能量 | |
| C. | 制造普通玻璃的主要反應原理之一為:CaO+SiO2$\frac{\underline{\;高溫\;}}{\;}$=CaSiO3 | |
| D. | 青霉素是最早發現的天然抗生素,其中起治療作用的是水楊酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 性質 | 應用 | |
| A | 鐵比銅金屬性強 | 可用FeCl3溶液腐蝕Cu制印刷電路板 |
| B | 活性炭具有吸附性 | 可用活性炭去除冰箱中的異味 |
| C | 油污在一定條件下會發生水解反應 | 可用熱的純堿溶液清除炊具上的油污 |
| D | 氫氟酸能與二氧化硅反應 | 可用氫氟酸在玻璃器皿上刻蝕標記 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 高鐵酸鉀中鐵顯+6價 | |
| B. | Fe3+的氧化性強于FeO42- | |
| C. | 上述反應中氧化劑和還原劑的物質的量之比為3:2 | |
| D. | 用K2FeO4處理廢水時其轉化為Fe3+,因此K2FeO4具有殺菌和吸附雙重作用 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在酒精燈加熱條件下,Na2CO3、NaHCO3固體都能發生分解 | |
| B. | 將AlCl3溶液滴加到濃氫氧化鈉溶液中,立即產生大量白色沉淀 | |
| C. | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液,若變為血紅色,Fe2+既有氧化性又有還原性 | |
| D. | 鐵粉作食品袋內的脫氧劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2通過Na2O2使其增重28 g 時,反應中轉移的電子數為0.5NA | |
| B. | 25℃時,Ksp(BaSO4)=1×10-10,則 Ba SO4飽和溶液中Ba2+數目為=1×10-5 NA | |
| C. | 標準狀況下,22.4 L CH2Cl2中共價鍵的數目為4NA | |
| D. | 高溫下,16.8g Fe與足量的水蒸氣完全反應失去電子的數目為0.8NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增加A 的量,平衡不移動 | |
| B. | 增加B 的量,平衡正向移動 | |
| C. | 升高體系溫度,平衡常數K 增大 | |
| D. | 壓縮氣體體積,正、逆反應速率均增大,平衡不移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(SO3 )=v(NO2) | |
| B. | 混合氣體的密度保持不變 | |
| C. | 混合氣體的顏色保持不變 | |
| D. | 每消耗1 mol SO3的同時生成1 mol NO2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com