
將0.05mol某烴完全燃燒生成的產物依次通過濃硫酸和堿石灰,濃硫酸增重5.4克,堿石灰增重13.2克,該烴能使酸性高錳酸鉀溶液褪色,若其結構中只含有一個亞甲基,則該烴的結構(不考慮立體異構)最多有
A.3種 B.4種 C.5種 D.6種
 三新快車金牌周周練系列答案
三新快車金牌周周練系列答案科目:高中化學 來源:2015-2016學年四川省高一下期中化學試卷(解析版) 題型:選擇題
在元素周期表中,主族元素自ⅢA族的硼到ⅦA族的砹連一條斜線,即為金屬和非金屬的分界線,從分界線附近可以找到( )
A.耐高溫材料 B.半導體材料 C.新型農藥材料 D.新型催化劑材料
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省高二下期中化學試卷(解析版) 題型:填空題
電解法處理含氮氧化物廢氣,可回收硝酸,具有較高的環境效益和經濟效益。實驗室模擬電解法吸收NOx的裝置如右圖所示(圖中電極均為石墨電極)。
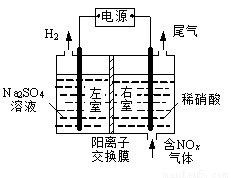
(1)若用NO2氣體進行模擬電解法吸收實驗。
①寫出電解時NO2發生反應的電極反應式: 。
②若有標準狀況下2.24 LNO2被吸收,通過陽離子交換膜(只允許陽離子通過)的H+為 mol。
(2)某小組在右室裝有10 L 0.2 mol/L硝酸,用含NO和NO2(不考慮NO2轉化為N2O4)的廢氣進行模擬電解法吸收實驗。
①實驗前,配制10 L 0.2mol/L硝酸溶液,需量取 mL的密度為1.4 g/mL、質量分數為63%的濃硝酸。
②電解過程中,有部分NO轉化為HNO2。實驗結束時,測得右室溶液中含3 molHNO3、0.1 molHNO2,同時左室收集到標準狀況下28 L H2。計算原氣體中NO和NO2的體積比(假設尾氣中不含氮氧化物,寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源:2016屆海南師大附中高三第九次月考化學試卷(解析版) 題型:選擇題
)某有機物 X 的結構簡式如下圖所示,則下列有關說法中正確的是( )
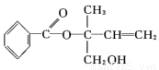
A.X的分子式為 C12H16O3
B.X在核磁共振氫譜圖中共出現8組峰
C.X在一定條件下能發生加成、加聚、取代、氧化等反應
D.在Ni作催化劑的條件下,1 mol X 最多只能與5 molH2加成
查看答案和解析>>
科目:高中化學 來源:2016屆海南師大附中高三第九次月考化學試卷(解析版) 題型:選擇題
下列反應的離子方程式書寫正確的是
A.硅酸鈉溶液與醋酸溶液混合:SiO32-+2H+=H2SiO3↓
B.NaHCO3溶液中加入過量的 Ba(OH)2溶液:HCO3-+Ba2++OH-= BaCO3↓+H2O
C.氯化鋁溶液中加入過量氨水 Al3++ 4NH3•H2O=AlO2-+ 4NH4++2H2O
D.用稀HNO3溶液FeS固體:FeS+2H+=Fe2++H2S↑
查看答案和解析>>
科目:高中化學 來源:2016屆海南師大附中高三第九次月考化學試卷(解析版) 題型:選擇題
化學與社會、環境密切相關,下列有關說法正確的是
A.蒸餾“地溝油”可以獲得汽油
B.明礬水解時產生具有吸附性的膠體粒子,可作漂白劑
C.綠色化學的核心是應用化學原理對環境污染進行治理
D.高純度的二氧化硅廣泛應用于制作光導纖維,光導纖維遇強堿會“斷路”
查看答案和解析>>
科目:高中化學 來源:2016屆海南中學高三高考模擬九化學試卷(解析版) 題型:實驗題
某研究性小組借助下列儀器裝置,驗證Ag與濃硝酸反應的過程中可能產生NO。從圖裝置C取25.00mL 待測溶液放入錐形瓶中,并滴加2 ~3滴酚酞作指示劑。用0.10 mol/ L NaOH的標準液進行滴定,到終點時,消耗NaOH溶液2.00mL。 根據此回答下列問題:
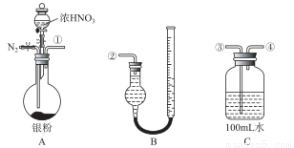
(1)滴定達到終點的標志是__________________________________;
(2)C中溶液硝酸的物質的量濃度為______________; Ag 與濃硝酸反應過程中生成標準狀況下的NO2體積為_______mL。
(3)用上圖所示儀器,組合一套用水吸收生成的 NO2,測定生成NO體積的裝置,其合理的連接順序是___________(填各導管的編號)。 反應前,先通入N2目的是___________________;
(4)在測定NO的體積時,B裝置右邊細管中液面比左邊的液面高,此時應將B裝置中的右邊細管位置____________(“下降”或“升高”),以保證B裝置中兩邊液面持平。
(5)若實驗測得NO的體積為112.0mL(已折算到標準狀況),則Ag與濃硝酸反應的過程中________(填“有”或“沒有”)NO 產生,作此的依據是___________________;
查看答案和解析>>
科目:高中化學 來源:2016屆海南中學高三高考模擬八化學試卷(解析版) 題型:實驗題
某工廠的廢渣中含NaCl、Mg ( OH) 2、CaCO3、BaCO3等,為實現變廢為寶,設計了以下工藝流程制備七水硫酸鎂。
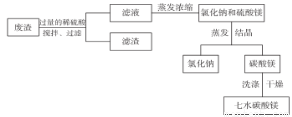
在廢渣中加入過量的稀硫酸,控制 pH為5.0,溫度在52℃左右,用攪拌器持續攪拌。
(1)攪拌的作用是為使反應充分進行,其化學原理為_____________________________;
(2)經過分析,過濾所得濾液中含有的離子的主要為 Na+、Mg2+、H+、SO42-、Cl-,為了除去H+,最好加入適量的_____________________________ (填化學式)。
(3)蒸發濃縮器的溶液中主要含有氯化鈉和硫酸鎂,通入高溫水蒸汽并控制溫度在100 ~ 110℃,蒸發濃縮結晶,此時析出的晶體主要是氯化鈉,說明此溫度下硫酸鎂的溶解度比氯化鈉____________ (“大”或“小”)。 結晶槽中硫酸鎂結晶的方法為_______________。
(5)為了檢驗所得 MgSO4·7H2O 是否純凈,具體的操作為____________。
查看答案和解析>>
科目:高中化學 來源:2016屆江西省高三5月月考理綜化學試卷(解析版) 題型:選擇題
常溫下,濃度均為0.10 mol/L、體積均為V0的HA和HB溶液,分別加水稀釋至體積V,pH隨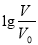 的變化如圖所示,下列敘述正確的是( )
的變化如圖所示,下列敘述正確的是( )
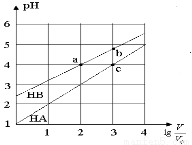
A.該溫度下HB的電離平衡常數約等于1.11×10-5
B.相同條件下NaA溶液的pH大于NaB溶液的pH
C.溶液中水的電離程度:a=c>b
D.當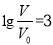 時,若兩溶液同時升高溫度,則
時,若兩溶液同時升高溫度,則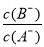 減小
減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com