

分析 流程中反應Ⅰ的化學化方程為CuFeS2+S═FeS2+CuS,黃銅礦與S在高溫下煅燒,使其轉變為FeS2、CuS,加入HCl、NaCl、CuCl2混合溶液 發生反應Cu2++CuS+4Cl-=2[CuCl2]-+S↓,過濾得到濾液中通入空氣發生反應4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O,一定溫度下,在反應Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸銅晶體,結晶分離得到硫酸銅晶體,加入鐵還原溶液得到銅;濾渣分離得到FeS和S.
(1)根據化合價規則計算元素的化合價;富銅礦砂與空氣在高溫下煅燒,使其轉變為銅,反應產物有污染性氣體二氧化硫生成;
(2)粉碎固體可以增大接觸面積,加快反應速率;反應Ⅰ的化學化方程為CuFeS2+S═FeS2+CuS,據化合價的變化來計算;
(3)反應Ⅲ中生成銅離子,離子反應為4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O,加入硫酸能析出硫酸銅,是因為硫酸銅的溶解度小于氯化銅的溶解度;
(4)煉鋼時,可將鐵紅投入熔融的生鐵中,濾液碳和氧化鐵反應生成鐵和一氧化碳;HSO3-電離得到H+、SO32-,而NH4+水解使溶液酸性增強,抑制HSO3-電離;
(5)利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,可知,3SO2~Cr2O72-,以此計算.
解答 解:流程中反應Ⅰ的化學化方程為CuFeS2+S═FeS2+CuS,黃銅礦與S在高溫下煅燒,使其轉變為FeS2、CuS,加入HCl、NaCl、CuCl2混合溶液 發生反應Cu2++CuS+4Cl-=2[CuCl2]-+S↓,過濾得到濾液中通入空氣發生反應4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O,一定溫度下,在反應Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸銅晶體,結晶分離得到硫酸銅晶體,加入鐵還原溶液得到銅;濾渣分離得到FeS和S,
(1)反應Ⅲ中的CuCl2-中Cl是-1價,銅元素的化合價為+1價,富銅礦砂與空氣在高溫下煅燒,要消耗大量的熱能,生成SO2會導致大氣污染,故答案為:+1;SO2會導致大氣污染;
(2)粉碎固體可以增大接觸面積,加快反應速率,則為使反應Ⅰ充分進行,工業上可采取的措施是粉碎固體等,流程中反應Ⅰ的化學化方程為CuFeS2+S═FeS2+CuS,
反應Ⅰ生成120gFeS2轉移的電子1mol,所以反應Ⅰ生成12gFeS2轉移的電子數為0.1NA,
故答案為:粉碎固體等;0.1NA;
(3)反應Ⅲ中生成銅離子,則離子反應為4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O,相同條件下硫酸銅的溶解度小,則該溫度下,硫酸銅的溶解度小于氯化銅,所以向反應Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸銅晶體,
故答案為:4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O;該溫度下,硫酸銅的溶解度小于氯化銅;
(4)煉鋼時,可將鐵紅投入熔融的生鐵中,濾液碳和氧化鐵反應生成鐵和一氧化碳,反應的化學方程式為:3C+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO↑,HSO3-?H++SO32-,而NH4+水解:NH4++H2O?NH3.H2O+H+,使溶液中c(H+)增大,抑制HSO3-電離,故NH4HSO3溶液中SO32-濃度較小,
故答案為:3C+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO↑;NH4HSO3;
(5)發生氧化還原反應生成硫酸亞鐵,離子反應為SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,
可知,3SO2~Cr2O72-,
3 1
x 0.02mol/L×0.025L
解得x=0.0015mol,
反應Ⅳ所得氣體中SO2的體積分數為:$\frac{0.0015mol}{\frac{0.28L}{22.4L/mol}}$×100%=12.00%,
故答案為:12.00%.
點評 本題以實際化工生產“黃銅礦的綜合利用”為背景,考查了元素化合物知識,離子方程式和化學方程式的書寫及有關計算,題目更注重考查學生利用化學原理來解決實際問題的能力,利用關系式計算可簡化計算.


科目:高中化學 來源: 題型:選擇題
| A. | 加 Ba(OH)2溶液,產生大量沉淀 | |
| B. | 加Ba(OH)2溶液,產生大量沉淀;再加鹽酸,沉淀溶解,同時產生氣體 | |
| C. | 加Ba(OH)2溶液,產生大量沉淀;再加鹽酸,沉淀溶解,同時產生無色無味能使澄清石灰水變渾濁的氣體 | |
| D. | 加BaCl2溶液,沒有沉淀,再加NaOH溶液,產生大量沉淀;最后加鹽酸,沉淀溶解,同時產生無色無味能使澄清石灰水變渾濁的氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 糖類物質都有甜味,有甜味的物質都是糖類物質 | |
| B. | 蛋白質水解產物氨基酸可以合成人體所需蛋白質 | |
| C. | 蠶絲、羊毛和淀粉分別屬于纖維素、蛋白質和多糖 | |
| D. | 食品包裝袋、食物保鮮膜等材料的主要成份是聚氯乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
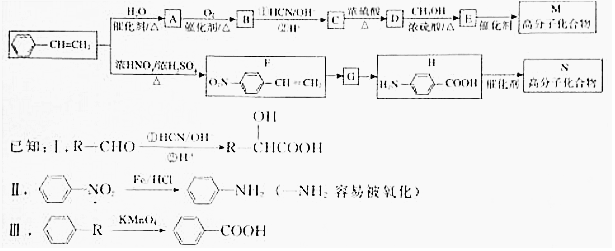
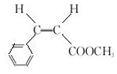 .
. 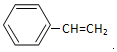 →F的反應類型為取代 反應.
→F的反應類型為取代 反應.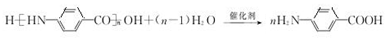 .
.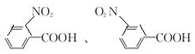 .
.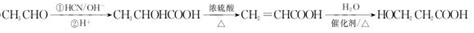 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含金屬元素的離子不一定都是陽離子 | |
| B. | 在氧化還原反應中,非金屬單質一定是氧化劑 | |
| C. | 最高價含氧酸一定具有強氧化性 | |
| D. | 金屬陽離子被還原一定得到金屬單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
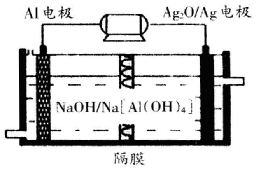 碳、氮和鋁的單質及其化合物在工農業生產和生活中有重要用途.
碳、氮和鋁的單質及其化合物在工農業生產和生活中有重要用途. | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | O2是氧化劑,S2O32-、Fe2+ 是還原劑 | |
| B. | 當有1 mol Fe3O4生成時共轉移的電子為4mol | |
| C. | 若有3mol Fe2+ 參加反應,則被Fe2+還原的O2為1mol | |
| D. | 若有2mol Fe2+ 被氧化,則被Fe2+還原的O2為0.5mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com