碘及其化合物在生產、生活和科技等方面都有著重要的應用.回答下列問題:
(1)保存碘單質時應注意的問題是
.
(2)碘不易溶于水,但易溶于碘化鉀溶液并生成多碘離子:
①I
2(aq)+I
-(aq)?I
3-(aq)△H<0 ②I
2(aq)+2I
-(aq)?I
42-(aq)反應②的平衡常數K=
(填表達式).溫度升高時,反應①的平衡常數將
(填“增大”不變”或“減小”).
(3)碘與鎢在一定溫度下,可發生如下的可逆反應:W(s)+I
2(g)?WI
2(g).現準確稱取0.508g碘、0.736g金屬鎢放置于50.0mL的密閉容器中,并加熱使其反應.如圖是混合氣體中的WI
2蒸氣的物質的量隨時間變化關系的圖象[n(WI
2)-t],其中曲線I(0~t
2時間段)的反應溫度為450℃,曲線Ⅱ(從t
2時刻開始)的反應溫度為530℃.
①該反應△H
0(填“>”或“<”).
②反應從開始到t
1(t
1=3min)時間內的平均速率υ(I
2)=
.
③在450℃時,該反應的平衡常數K=
.
④能夠說明上述反應已經達到平衡狀態的有
.
A.I
2與WI
2的濃度相等
B.單位時間內,金屬鎢消耗的物質的量與單質碘生成的物質的量相等
C.容器內混合氣體的密度不再增加
D.容器內氣體壓強不變化
(4)I
2O
5是白色粉末狀固體,可用作氧化劑使H
2S、CO、HCl等被氧化,在合成氨工業中常用I
2O
5來定量測量CO的含量.已知:
①2I
2(s)+5O
2(g)=2I
2O
5(s)△H=-75.56kJ?mol
-1②2CO(g)+O
2(g)=2CO
2(g)△H=-566.0kJ?mol
-1寫出CO(g)與I
2O
5(s)反應析出固態I
2的熱化學方程式:
.

 碘及其化合物在生產、生活和科技等方面都有著重要的應用.回答下列問題:
碘及其化合物在生產、生活和科技等方面都有著重要的應用.回答下列問題:

 閱讀快車系列答案
閱讀快車系列答案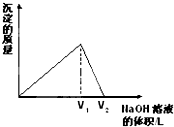 向aL一定濃度的AlCl3溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的質量與滴入NaOH溶液體積的關系如圖所示.下列代數式中不能表示AlCl3溶液中AlCl3的物質的量濃度的數值的是( )
向aL一定濃度的AlCl3溶液中,逐滴加入c mol/L的NaOH溶液,生成沉淀的質量與滴入NaOH溶液體積的關系如圖所示.下列代數式中不能表示AlCl3溶液中AlCl3的物質的量濃度的數值的是( )