
室溫下,下列離子組在給定條件下一定能大量共存的是
A. pH=1的溶液中:K+、Na+、NO3-、CH3COO-
B. Na2S溶液中:K+、Na+、NO3-、Ag+
C. KCl溶液中:Na+、Fe3+、SO42-、SCN-
D. c(OH-)=1×10-13mol·L-1的溶液中:K+、Mg2+、Cl-、NO3-
科目:高中化學 來源:2017屆四川省高三上學期第四次月考理科綜合化學試卷(解析版) 題型:簡答題
霧霾天氣是一種大氣污染狀態,霧霾的源頭多種多樣,比如汽車尾氣、工業排放、建筑揚塵、垃圾焚燒,甚至火山噴發等。
(1)汽車尾氣中的NO(g)和CO(g)在一定溫度和催化劑的條件下可凈化。
①已知部分化學鍵的鍵能如下
分子式/結構式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化學鍵 | N≡O | C≡O | C=O | N≡N |
鍵能(KJ/mol) | 632 | 1072 | 750 | 946 |
請完成汽車尾氣凈化中NO(g)和CO(g)發生反應的熱化學方程式
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=_________kJ/mol
N2(g)+2CO2(g) ΔH=_________kJ/mol
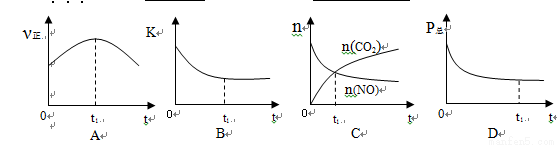
②若上述反應在恒溫、恒容的密閉體系中進行,并在t1時刻達到平衡狀態,則下列示意圖不符合題意的是_________(填選項序號)。(下圖中v正、K、n、P總分別表示正反應速率、平衡常數、物質的量和總壓強)
 (2)在t1℃下,向體積為10L的恒容密閉容器中通入NO和CO , 測得了不同時間時NO和CO的物質的量如下表:
(2)在t1℃下,向體積為10L的恒容密閉容器中通入NO和CO , 測得了不同時間時NO和CO的物質的量如下表:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×l0-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×l0-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃時該反應的平衡常數K=__,既能增大反應速率又能使平衡正向移動的措施是_。(寫出一種即可)
(3)如圖1所示,以N2O4為原料采用電解法可制備新型綠色硝化劑(一種氮氧化物)寫出生成這種硝化劑的陽極電極反應式________________________。
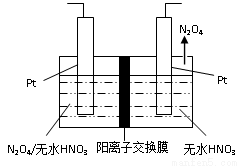
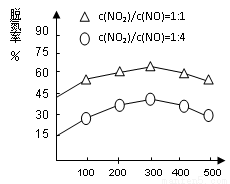
圖1 圖2
(4)NH3催化還原氮氧化物(SCR)技術是目前應用最廣泛的煙氣氮氧化物脫除技術。在氨氣足量的情況下,不同c(NO2)/c(NO)、不同溫度對脫氮率的影響如圖2所示(已知氨氣催化還原氮氧化物的正反應為放熱反應),請回答溫度對脫氮率的影響____________________,給出合理的解釋:____________________________________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省高一下學期第一次月考化學試卷(解析版) 題型:選擇題
現有MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl五種溶液,只用一種試劑就能夠將它們區別開,這種試劑是( )
A. 氨水 B. AgNO3 C. NaCl D. 濃NaOH
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省邯鄲市高二上學期期末考試化學試卷(解析版) 題型:簡答題
向一容積為5L的恒容密閉容器內,充入0.2molCO和0.4molH2O,在一定條件下發生反應:CO(g)+H2O(g) CO2(g)+H2(g) ΔH>0。反應中CO2的濃度(c)隨時間(t)的變化關系如圖所示。
CO2(g)+H2(g) ΔH>0。反應中CO2的濃度(c)隨時間(t)的變化關系如圖所示。
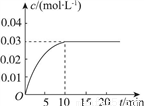
回答下列問題:
(1)下列敘述能判斷該反應達到平衡狀態的是________(填序號)。
①H2O的質量不再變化
②混合氣體的總壓強不再變化
③CO、H2O、CO2、H2的濃度都相等
④單位時間內生成amolCO,同時生成amolH2
(2)0~10min時段,反應速率v(H2)=________;反應達到平衡時,c(H2O)=________,CO的轉化率為________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省邯鄲市高二上學期期末考試化學試卷(解析版) 題型:選擇題
某溫度下,在一恒容密閉容器中進行可逆反應:X(g)+Y(g)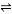 Z(g)+W(s) ΔH>0,下列敘述正確的是
Z(g)+W(s) ΔH>0,下列敘述正確的是
A. 當容器中混合氣體的壓強不再變化時,反應達到平衡
B. 平衡后加入少量W,逆反應速率增大
C. 平衡后升高溫度,平衡逆向移動
D. 平衡后加入X,ΔH增大
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省邯鄲市高二上學期期末考試化學試卷(解析版) 題型:選擇題
下列事實不能用勒夏特列原理解釋的是
A. 對平衡體系H2(g)+I2(g) 2HI(g)加壓后,混合氣體的顏色加深
2HI(g)加壓后,混合氣體的顏色加深
B. 用稀鹽酸洗滌AgCl沉淀比用等體積的蒸餾水洗滌損失的AgCl少
C. 實驗室可用排飽和食鹽水的方法收集氯氣
D. 工業合成三氧化硫的過程中使用過量的氧氣,以提高二氧化硫的轉化率
查看答案和解析>>
科目:高中化學 來源:2017屆江西省南昌市高三第一次模擬考試理綜化學試卷(解析版) 題型:簡答題
水合堿式碳酸鎂[4MgC03·Mg(OH)2·4H2O〕,又稱輕質碳酸鎂。常利用菱鎂礦(質量含量為碳酸鎂90% ,碳酸鈣10%〕碳化法制取:

(1)根據下列表格數據,選擇消化反應的最佳溫度_____;理由是__________。

(2)碳化反應可生成Mg(HCO3)2,生成Mg(HCO3)2的化學方程式為_______。
(3)流程圖中______和_____可以為碳化反應提供二氧化碳源。
(4)有工藝設計利用鹵水碳化法制取輕質碳酸鎂:
①鹵水中含有Fe2+和Mn2+,當其濃度小于1×10-5時,可以認為完全除去。常溫時當調節溶液pH為9.5時,此時Mn2+小于_____mol/L,不會沉淀出來。

②如果把Fe2+轉化為Fe3+,從環境角度選擇最合適的氧化劑為______。
A. Ca(C10)2 B. Cl2 C. H202 D. HNO3
③下列方案中,較好的為_______,理由是___________。

查看答案和解析>>
科目:高中化學 來源:2017屆河南省濮陽市高三第一次模擬考試理綜化學試卷(解析版) 題型:選擇題
根據下列實驗操作預測的實驗現象正確的是
實驗操作 | 預測的實驗現象 | |
A | 向Na2CO3溶液中滴加鹽酸 | 立即有氣體逸出 |
B | 將濃硫酸滴加到盛有銅片的試管中,并將蘸有品紅溶液的試紙置于試管口 | 試紙褪色 |
C | 鋁箔在酒精燈火焰上加熱 | 鋁熔化但不會滴下 |
D | 向淀粉的水解液中加入新制Cu(OH)2懸濁液并加熱 | 一定有磚紅色沉淀生成 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:2017屆海南省瓊海市高三下學期第一次月考化學試卷(解析版) 題型:選擇題
一定溫度下,體積不變的密閉容器中,對可逆反應A(g) + 2B(g)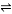 3C(g) + D(s) 的下列敘述中,能說明反應已達到平衡的是:
3C(g) + D(s) 的下列敘述中,能說明反應已達到平衡的是:
A. 單位時間內消耗a mol A,同時生成3a mol C
B. C的生成速率與C的分解速率相等
C. 混合氣體的總物質的量不再變化
D. 容器內的壓強不再變化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com