
分析 (1)利用題中信息可知Se與濃HNO3反應,Se被氧化為+4價的H2SeO3,HNO3還原為NO與NO2,利用電子守恒和限定條件(生成NO與NO2的物質的量之比為1:1,即二者計量系數比為1:1)可得方程式;
(2)在氧化還原反應中,氧化劑的氧化性強于氧化產物的,而還原劑的還原性強于還原產物的;
(3)反應①中I-失去電子生成I2,共升高2價,SeO2中+4價Se得到單質還原為單質Se,共降低4價,化合價升降最小公倍數為4,進而確定各物質的量的系數配平方程式,確定轉移電子數目,標出電子轉移的方向和數目;
(4)根據反應的方程式可知,SeO2~2I2~4Na2S2O3,根據n=cV計算消耗的n(Na2S2O3),根據關系式計算樣品中n(SeO2),再根據m=nM計算SeO2的質量,進而計算樣品中SeO2的質量分數.
解答 解:(1)利用題中信息可知Se與濃HNO3反應,Se被氧化為+4價的H2SeO3,HNO3還原為NO與NO2,生成NO與NO2的物質的量之比為1:1,即二者計量系數比為1:1,令二者系數為1,根據電子轉移守恒可知,Se的系數為$\frac{1×3+1×1}{4}$=1,故反應方程式為:Se+2HNO3(濃)=H2SeO3+NO↑+NO2↑,
故答案為:Se+2HNO3(濃)=H2SeO3+NO↑+NO2↑;
(2)在氧化還原反應中,氧化劑的氧化性強于氧化產物的,所以根據反應的方程式可知,SeO2、H2SO4(濃)、SO2的氧化性由強到弱的順序是H2SO4(濃)>SeO2>SO2,故答案為:H2SO4(濃)>SeO2>SO2;
(3)反應①中I-失去電子生成I2,共升高2價,SeO2中+4價Se得到單質還原為單質Se,共降低4價,化合價升降最小公倍數為4,故KI的系數為4,I2的系數為2,SeO2、Se的系數都是1,KNO3的系數為4,H2O的系數為2,配平并標出電子轉移的方向和數目為: ,
,
故答案為:1,4,4,1,2,4,2; ;
;
(4)根據反應的方程式可知SeO2~2I2~4Na2S2O3,消耗的n(Na2S2O3)=0.2000 mol/L×0.025L=0.005mol,
根據關系式計算樣品中n(SeO2)=0.005mol×$\frac{1}{4}$=0.00125mol,
故SeO2的質量為0.00125mol×111g/mol=0.13875g,
所以樣品中SeO2的質量分數為:$\frac{0.13875g}{0.1500g}$×100%=92.50%,
故答案為:92.50%.
點評 本題考查氧化還原反應有關知識,涉及氧化性強弱比較、氧化還原反應配平、電子轉移表示、氧化還原反應滴定計算等,難度中等,注意(4)中根據關系式的計算.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 膠體區別于其它分散系的本質特征是分散質的微粒直徑在1nm~100nm之間 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3膠體,可以加以區分 | |
| C. | 把FeCl3飽和溶液滴入到NaOH溶液中,以制取Fe(OH)3膠體 | |
| D. | 膠體是一種介穩性的分散系,其粒子能通過濾紙 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+ | B. | SO42- | C. | OH- | D. | Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 9種 | B. | 6種 | C. | 5種 | D. | 4種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
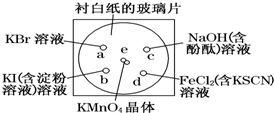 化學實驗的微型化可有效地減少污染,實現化學實驗綠色化的要求.某學生按下列操作做一個實驗:在一塊下襯白紙的玻璃片的不同位置分別滴加濃度為0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每種液滴彼此分開,圍成半徑小于表面皿的圓形(如下圖所示),在圓心處放置2粒芝麻粒大小的KMnO4晶體,向KMnO4晶體滴加一滴濃鹽酸,再立即將表面皿蓋好.(已知:2KMnO4+16HCl(濃)═2KCl+2MnCl2+5Cl2↑+8H2O
化學實驗的微型化可有效地減少污染,實現化學實驗綠色化的要求.某學生按下列操作做一個實驗:在一塊下襯白紙的玻璃片的不同位置分別滴加濃度為0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每種液滴彼此分開,圍成半徑小于表面皿的圓形(如下圖所示),在圓心處放置2粒芝麻粒大小的KMnO4晶體,向KMnO4晶體滴加一滴濃鹽酸,再立即將表面皿蓋好.(已知:2KMnO4+16HCl(濃)═2KCl+2MnCl2+5Cl2↑+8H2O查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com