
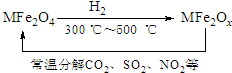 新型納米材料氧缺位鐵酸鹽MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均為+2價,下同)是由鐵酸鹽MFe2O4經過高溫與H2反應制得.常溫下,它能使工業廢氣中的酸性氧化物(SO2、NO2等)轉化為其單質除去,轉化流程如圖:
新型納米材料氧缺位鐵酸鹽MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均為+2價,下同)是由鐵酸鹽MFe2O4經過高溫與H2反應制得.常溫下,它能使工業廢氣中的酸性氧化物(SO2、NO2等)轉化為其單質除去,轉化流程如圖:分析 (1)納米材料氧缺位鐵酸鹽微粒直徑達到膠體微粒直徑;
(2)M=Mn、Zn、Ni,且均為+2價,根據化合價規則確定元素的化合價;
(3)MFe2O4在與H2的反應中,Fe元素的化合價降低;
(4)由示意圖可知MFe2Ox與SO2反應,生成MFe2O4,SO2被還原,應生成S,反應可表示為MFe2Ox+SO2→MFe2O4+S,根據電子守恒來計算回答;
(5)在酸性條件下,Fe2O42-容易轉化為Fe2+,為還原反應,則應加入還原性物質,根據基本概念來回答.
解答 解:(1)納米材料氧缺位鐵酸鹽微粒直徑達到膠體微粒直徑,分散在蒸餾水中,所形成的分散系屬于膠體,故答案為:膠體;
(2)M=Mn、Zn、Ni,且均為+2價,氧元素的化合價是-2價,根據化合價規則,MFe2O4中Fe元素的化合價為+3價,故答案為:+3;
(3)MFe2O4在與H2的反應中,Fe元素的化合價降低,則MFe2O4在與H2的反應中表現了氧化性,故答案為:氧化性;
(4)由示意圖可知MFe2Ox與SO2反應,生成MFe2O4,SO2被還原,應生成S,反應可表示為:MFe2Ox+$\frac{4-x}{2}$SO2=MFe2O4+$\frac{4-x}{2}$S,$\frac{1}{\frac{4-x}{2}}=\frac{5}{1}$,解得x=3.6,
故答案為:3.6;
(5)在酸性溶液中,Fe2O42-易轉化為Fe2+:Fe2O42-+2e-+8H+═2Fe2++4H2O為還原反應,則應加入還原性物質,只有Cu2O符合,反應的化學方程式為:Fe2O42-+Cu2O+10H+=2Fe2++2Cu2++5H2O,所以還原劑是Cu2O,Fe2O42-是氧化劑,故答案為:Fe2O42-;Cu2O.
點評 本題綜合考查氧化還原反應知識等,側重于學生的分析能力和計算能力的考查,注意理解題目信息從元素化合價的角度解答該題,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 硫酸溶液與氫氧化鋇溶液反應:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| B. | 氯氣溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| C. | 金屬鈉投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向氯化鋁溶液中加入足量氨水:A13++4NH3•H2O═AlO2-+2H2O+4NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子是由原子核和核外電子構成的 | |
| B. | 保持水的化學性質的粒子是水分子 | |
| C. | 分子的質量總比原子的質量大 | |
| D. | 在化學反應中分子可分而原子不可分 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 常溫下,準確稱取14.8gCa(OH)2,配置100mL2.0mol/L的Ca(OH)2溶液 | |
| B. | 在溴富集過程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,震蕩,靜置、分液,得下層液體 | |
| C. | 海洋植物具有富集碘的能力,因此從海產品中提取碘是工業上獲取碘的重要途徑,工業上從海帶中提取碘經歷的步驟有:浸泡-過濾-氧化-萃取-粗碘提純 | |
| D. | NaCl溶液蒸發結晶時,蒸發皿中有晶體析出并剩余少量液體時停止加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 向100mLNaOH溶液中通入一定量的CO2氣體,充分反應后,再向所得溶液中逐滴加入1mol/L的鹽酸,產生CO2的體積與所加稀鹽酸體積之間關系如圖所示.
向100mLNaOH溶液中通入一定量的CO2氣體,充分反應后,再向所得溶液中逐滴加入1mol/L的鹽酸,產生CO2的體積與所加稀鹽酸體積之間關系如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S→SO3 | B. | Al2O3→Al(OH)3 | C. | SiO2→H2SiO3 | D. | Na2O→NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3COOH═CH3COO-+H+ | B. | NaOH═Na++OH- | ||
| C. | H2SO4═H++SO42- | D. | KClO3═K++Cl-+3O2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ca(HCO3 )2與澄清石灰水反應可以表示為:2Ca2++3HCO${\;}_{3}^{-}$+3OH-═2CaCO3↓+CO${\;}_{3}^{2-}$+3H2O | |
| B. | 用Pt電極電解少量的CuC12溶液:2H2O+Cu2++2Cl-═H2↑+Cl2↑+Cu(OH)2↓ | |
| C. | 向CuSO4,溶液中加人Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| D. | 向NaCIO和NaCI混合溶液中滴人少量FeSO4溶液:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com