
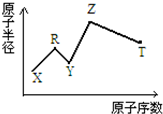
 現有短周期主族元素X、Y、Z、R、T.R原子最外層電子數是電子層數的2倍;Y與Z能形成Z2Y、Z2Y2型離子化合物,Z與T形成的Z2T 化合物能破壞水的電離平衡.六種元素的原子半徑與原子序數的關系如圖所示.下列推斷正確的是( )
現有短周期主族元素X、Y、Z、R、T.R原子最外層電子數是電子層數的2倍;Y與Z能形成Z2Y、Z2Y2型離子化合物,Z與T形成的Z2T 化合物能破壞水的電離平衡.六種元素的原子半徑與原子序數的關系如圖所示.下列推斷正確的是( )| A. | 原子半徑和離子半徑均滿足:Y<Z | |
| B. | 氫化物的沸點排序:Y>T>R | |
| C. | 最高價氧化物對應的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四種元素組成的化合物水溶液一定顯酸性 |
分析 短周期主族元素中,R原子最外層電子數是電子層數的2倍,可能為C或S,由于圖示原子半徑和原子序數關系可知R應為C;Y與Z能形成Z2Y、Z2Y2型離子化合物,應為Na2O、Na2O2,則Y為O,Z為Na;Z與T形成的Z2T化合物能破壞水的電離平衡,T應為S,Na2S水解呈堿性,可促進水的電離;X的原子半徑最小,原子序數最小,應為H元素,結合對應單質、化合物的性質以及題目要求解答該題.
解答 解:短周期主族元素中,R原子最外層電子數是電子層數的2倍,可能為C或S,由于圖示原子半徑和原子序數關系可知R應為C;Y與Z能形成Z2Y、Z2Y2型離子化合物,應為Na2O、Na2O2,則Y為O,Z為Na;Z與T形成的Z2T化合物能破壞水的電離平衡,T應為S,Na2S水解呈堿性,可促進水的電離;X的原子半徑最小,原子序數最小,應為H元素.
A.原子半徑O>Na,離子半徑O2->Na+,故A錯誤;
B.Y、T、R的簡單氫化物分別為H2O、H2S、CH4,水分子之間存在氫鍵,沸點最高,硫化氫相對分子質量大于甲烷的,分子間作用力較甲烷的強,故硫化氫的沸點高于甲烷的,故沸點H2O>H2S>CH4,故B正確;
C.非金屬性S>C,元素的非金屬性越強,對應的最高價氧化物的水化物的酸性越強,故C錯誤;
D.由H、C、O、Na四種元素組成的化合物不僅僅為NaHCO3,可能為有機鹽且含有羧基,溶液不一定為堿性,可能為酸性,故D錯誤.
故選B.
點評 本題考查結構性質位置關系應用,側重于學生的分析能力的考查,推斷元素是解題的關鍵,D為易錯點,學生容易忽略有機物,難度中等.


 狀元及第系列答案
狀元及第系列答案 同步奧數系列答案
同步奧數系列答案科目:高中化學 來源: 題型:選擇題
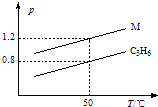 圖中兩條曲線分別表示1g C3H6、1g M氣體在相同體積的容器中壓強和溫度的關系,試據圖形判斷M氣體可能是( )
圖中兩條曲線分別表示1g C3H6、1g M氣體在相同體積的容器中壓強和溫度的關系,試據圖形判斷M氣體可能是( )| A. | SO2 | B. | CO2 | C. | C3H8 | D. | CO和N2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
; ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
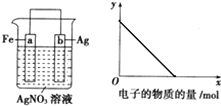 按如圖裝置進行實驗,若x軸表示流入正極的電子的物質的量,則y軸可以表示( )
按如圖裝置進行實驗,若x軸表示流入正極的電子的物質的量,則y軸可以表示( )| A. | ①③ | B. | ②④ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增加A的量,B的轉化率提高 | |
| B. | 壓強增大平衡不移動,v(正)、v(逆)均不變 | |
| C. | 增大B的濃度,v(正)>v(逆) | |
| D. | 升高溫度,平衡向逆反應方向移動,v(正)減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| A元素的核外電子數和電子層數相等,也是宇宙中最豐富的元素 |
| B元素原子的核外p電子數比s電子數少1 |
| C原子的第一至第四電離能分別是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p軌道全滿或半滿 |
| E元素的主族序數與周期數的差為4 |
| F是前四周期中電負性最小的元素 |
| G在周期表的第七列 |
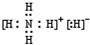 .
.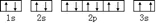 該同學所畫的電子排布圖違背了泡利原理.
該同學所畫的電子排布圖違背了泡利原理.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com