
【題目】判斷正誤(在答題卡表格中①~題題號對應位置畫“√”或“×”)。
(1)2020年6月23日9時43分北斗系統第五十五顆導航衛星暨北斗三號最后一顆全球組網衛星成功發射!執行本次發射任務的長三乙運載火箭加裝的常規燃料為偏二甲肼(C2H8N2)和四氧化二氮。偏二甲肼和四氧化二氮也可以作為燃料電池的兩極反應物。二者反應的產物均對環境不產生污染。根據以上信息判斷下列說法正誤:
①偏二甲肼是有機物,其中氮元素化合價為-3_____
②生成1molCO2轉移8mol電子_____
③偏二甲肼與四氧化二氮的反應是放熱反應_____
④該燃料電池中偏二甲肼是負極反應物_____
(2)如圖所示裝置,用生成的氯氣與乙二醛制備乙二酸,反應原理為![]() +2Cl2+2H2O→
+2Cl2+2H2O→![]() +4HCl。
+4HCl。
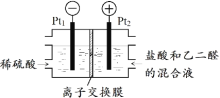
判斷以下說法的正誤:
⑤該裝置利用上述反應將電能全部轉化為化學能_____
⑥Pt1電極的反應式為2H2O+2e-=H2↑+2OH-_____
⑦鹽酸除增強溶液導電性的作用,還提供Cl-參與電極反應_____
⑧理論上每得到0.1mol乙二酸,將有0.4molH+從右室遷移到左室_____
(3)判斷對下列圖像的描述的正誤:
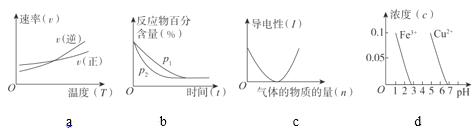
⑨根據圖a可判斷反應A2(g)+3B2(g)![]() 2AB3(g)的ΔH>0_____
2AB3(g)的ΔH>0_____
⑩圖b可表示壓強(P)對反應2A(g)+2B(g)![]() 3C(g)+D(s)的影響_____
3C(g)+D(s)的影響_____
圖c可表示向醋酸溶液通入氨氣時,溶液導電性隨氨氣量的變化_____
根據圖d,除去CuSO4溶液中的Fe3+,可加入NaOH調節pH至3~4_____
(4)利用如下實驗探究鐵釘在不同溶液中的吸氧腐蝕。
實驗裝置 | 實驗編號 | 浸泡液 | pH | 氧氣濃度隨時間的變化 |
| i | H2O | 7 |
|
ii | 1.0mol·L-1NH4Cl | 5 | ||
iii | 0.5mol·L11(NHspan>4)2SO4 | 5 | ||
iv | 1.0mol·L-1NaCl | 7 | ||
v | 0.5mol·L-1Na2SO4 | 7 |
通過以上實驗判斷下列說法正誤:
i與iv、v比較說明鹽溶液可以加快吸氧腐蝕速率_____
ii與iii、iv與v比較說明吸氧腐蝕速率與陰離子種類無關_____
向實驗v溶液中加入少量(NH4)2SO4固體,吸氧腐蝕速率加快_____
向實驗ii溶液中加等體積的0.5mol·L-1(NH4)2SO4,吸氧腐蝕速率一定加快_____
【答案】× √ √ √ × × √ √ × × × √ √ × √ ×
【解析】
根據偏二甲肼的分子結構及相關元素的非金屬性的強弱關系判斷N元素的化合價,根據氧化還原反應中的電子轉移進行相關計算;根據燃料電池的特點及原電池原理分析相關的問題;根據影響化學平衡的因素及平衡移動原理分析相關問題;根據強電解質和弱電解質的電離特點分析溶液導電性的變化;根據控制變量法分析相關的實驗數據。
(1)偏二甲肼和四氧化二氮也可以作為燃料電池的兩極反應物。二者反應的產物均對環境不產生污染,則反應產物為CO2、N2和H2O,該反應的化學方程式為C2H8N2+2N2O42CO2+3N2+4H2O。
①偏二甲肼(C2H8N2)是有機物,其結構簡式為(CH3)2N-NH2),其中兩個氮原子之間形成一對共用電子對,該共價鍵為非極性鍵,其他的共價鍵均為極性鍵,由于在該有機物中N元素的非金屬性最強,故其化合價為-2,①不正確,畫×;
②C2H8N2+2N2O42CO2+3N2+4H2O,該反應中,N2O4是氧化劑,其中N由+4降低到0,C2H8N2是還原劑,電子轉移的數目是16e-,因此生成1molCO2轉移8mol電子,②正確,畫√;
③偏二甲肼和四氧化二氮也可以作為燃料電池的兩極反應物,因此偏二甲肼與四氧化二氮的反應是放熱反應,③正確,畫√;
④燃料在燃料電池的負極發生氧化反應,所以該燃料電池中偏二甲肼是負極反應物,④正確,畫√;
(2)⑤在電解過程中,電能不可能全部轉化為化學能,有一部分會轉化為熱能,故⑤不正確,畫×;
⑥Pt1電極為陰極,稀硫酸中的H+放電生成氫氣,電極反應式為2H++2e-=H2↑,⑥不正確,畫×;
⑦鹽酸中的Cl-在陽極上放電生成Cl2,然后氯氣把乙二醛氧化為乙二酸,所以,鹽酸除增強溶液導電性的作用,還提供Cl-參與電極反應,⑦正確,畫√;
⑧陽極區的總反應為![]() -4e-+2H2O→
-4e-+2H2O→![]() +4H+,陰極反應為4H++4e-=2H2↑,所以離子交換膜為陽離子交換膜,理論上每得到0.1mol乙二酸,將有0.4molH+從右室遷移到左室⑧正確,畫√;
+4H+,陰極反應為4H++4e-=2H2↑,所以離子交換膜為陽離子交換膜,理論上每得到0.1mol乙二酸,將有0.4molH+從右室遷移到左室⑧正確,畫√;
(3)⑨根據圖a可知,該反應在圖中兩線交點處,正反應速率與逆反應速率相等,達到化學平衡狀態,此后升高溫度,逆反應速率增大程度較大,故平衡向逆反應方向移動,則逆反應為吸熱反應,正反應為放熱反應,因此可以判斷反應A2(g)+3B2(g)![]() 2AB3(g)的ΔH<0,⑨不正確,畫×;
2AB3(g)的ΔH<0,⑨不正確,畫×;
⑩2A(g)+2B(g)![]() 3C(g)+D(s),該反應物在建立平衡的過程中,氣體分子數在減少,若增大壓強,則化學平衡向正反應方向移動,反應物的百分含量將減小,因此,圖b不能表示壓強(P)對反應2A(g)+2B(g)
3C(g)+D(s),該反應物在建立平衡的過程中,氣體分子數在減少,若增大壓強,則化學平衡向正反應方向移動,反應物的百分含量將減小,因此,圖b不能表示壓強(P)對反應2A(g)+2B(g)![]() 3C(g)+D(s)的影響,⑩不正確,畫×;
3C(g)+D(s)的影響,⑩不正確,畫×;
醋酸是弱電解質,與氨氣反應后可以生成強電解質醋酸銨,故溶液的導電性增強,因此,圖c不能表示向醋酸溶液通入氨氣時溶液導電性隨氨氣量的變化,不正確,畫×;
根據圖d信息可知,pH約為3時,溶液中Fe3+的濃度為0,而Cu2+的濃度較大,因此,除去CuSO4溶液中的Fe3+,可加入NaOH調節pH至3~4,正確,畫√;
(4)由圖象中的信息可知,i與iv、v比較,前者單位時間內氧氣濃度的變化量較小,氧氣消耗得越快,說明吸氧腐蝕速率越快,因此,可以說明鹽溶液可以加快吸氧腐蝕速率,正確,畫√;
ii與iii、iv與v比較,僅陰離子種類不同,但是其腐蝕速率明顯不同,說明吸氧腐蝕速率與陰離子種類有關,不正確,畫×;
由圖象可知,在相同條件下,硫酸銨溶液的腐蝕速率明顯快于硫酸鈉溶液,因此,向實驗v溶液中加入少量(NH4)2SO4固體,吸氧腐蝕速率加快,正確,畫√;
向實驗ii溶液中加等體積的0.5mol·L-1(NH4)2SO4,兩種溶質的物質的量濃度均變為原來的一半,雖然銨根離子濃度與原溶液相同,但是氯離子的濃度變小了,故吸氧腐蝕速率減小,不正確,畫×。


 導學教程高中新課標系列答案
導學教程高中新課標系列答案科目:高中化學 來源: 題型:
【題目】下列關于苯的敘述正確的是
A.苯的分子式為C6H6,它不能使酸性KMnO4溶液褪色,屬于飽和烴
B.從苯的結構簡式 看,苯分子中含有碳碳雙鍵,應屬于烯烴
看,苯分子中含有碳碳雙鍵,應屬于烯烴
C.在催化劑作用下,苯與液溴反應生成溴苯,發生了加成反應
D.苯分子為平面正六邊形結構,6個碳原子之間的化學鍵完全相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯乙酸銅是合成優良催化劑、傳感材料——納米氧化銅的重要前驅體之一。下面是它的一種實驗室合成路線:
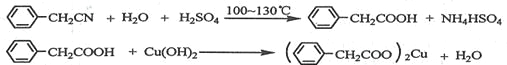
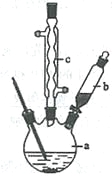
制備苯乙酸的裝置示意圖如下(加熱和夾持裝置等略):
已知:苯乙酸的熔點為76.5 ℃,微溶于冷水,溶于乙醇。
回答下列問題:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸時,加入蒸餾水與濃硫酸的先后順序是
__________________________。
(2)將a中的溶液加熱至100 ℃,緩緩滴加40 g苯乙腈到硫酸溶液中,然后升溫至130 ℃繼續反應。在裝置中,儀器b的作用是_____________________;儀器c的名稱是______________,其作用是___________________________________________。
反應結束后加適量冷水,再分離出苯乙酸粗品。加人冷水的目的是____________。下列儀器中可用于分離苯乙酸粗品的是________________(填標號)。
A.分液漏斗 | B.漏斗 | C.燒杯 | D.直形冷凝管E.玻璃棒 |
(3)提純粗苯乙酸的方法是_____________,最終得到44 g純品,則苯乙酸的產率是________。
(4)用CuCl2 2H2O和NaOH溶液制備適量Cu(OH)2沉淀,并多次用蒸餾水洗滌沉淀,判斷沉淀洗干凈的實驗操作和現象是____________________________________________。
(5)將苯乙酸加人到乙醇與水的混合溶劑中,充分溶解后,加入Cu(OH)2攪拌30min,過濾,濾液靜置一段時間,析出苯乙酸銅晶體,混合溶劑中乙醇的作用是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗現象或圖象信息不能充分說明相應的化學反應是放熱反應的是( )
A | B | C | D | |
反應裝置或圖象 |
|
|
|
|
實驗現象或圖象信息 | 溫度計的水銀柱上升 | 反應物總能量大于生成物總能量 | 反應開始后,針筒活塞向右移動 | 反應開始后,甲處液面低于乙處液面 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】80 ℃時,在2 L密閉容器中充入0.40 mol N2O4,發生反應N2O4(g) ![]() 2NO2(g) ΔH=+Q kJ·mol-1(Q>0),獲得如下數據:
2NO2(g) ΔH=+Q kJ·mol-1(Q>0),獲得如下數據:
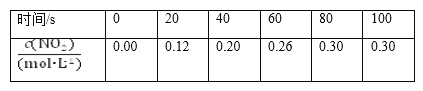
下列判斷正確的是( )。
A.升高溫度該反應的平衡常數K減小
B.20~40 s內,v(N2O4)=0.004 mol·L-1·s-1
C.反應達平衡時,吸收的熱量為0.30Q kJ
D.100 s時再通入0.40 mol N2O4,達到新平衡時N2O4的轉化率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】滴定的方法有酸堿中和滴定、沉淀滴定、絡合滴定等.沉淀滴定所用的指示劑本身就是一種沉淀劑,已知一些銀鹽的顏色和 ![]() 如下,測定水體中氯化物的含量,常用標準硝酸銀溶液進行滴定.
如下,測定水體中氯化物的含量,常用標準硝酸銀溶液進行滴定.
化學式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
顏色 | 白色 | 淺黃色 | 黃色 | 黑色 | 紅色 |
Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×1017 | 2.0×10-48 | 1.8×10-10 |
滴定時,你認為該滴定適宜選用的指示劑是下列中的
A.KIB.![]() C.KBrD.
C.KBrD.![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于鹽類水解的說法錯誤的是( )
A.pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物質的量濃度大小:①>②>③
B.濃度均為0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小順序為①>②>③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解
D.在CH3COONa溶液中加入冰醋酸,能抑制CH3COO-水解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相同溫度下,在體積相等的三個恒容密閉容器中發生可逆反應:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ/mol。實驗測得有關數據如下表:
2NH3(g) △H=-92.4 kJ/mol。實驗測得有關數據如下表:
容器編號 | 起始時各物質物質的量/mol | 平衡時反應中的能量變化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出熱量a kJ |
② | 2 | 3 | 0 | 放出熱量b kJ |
③ | 2 | 6 | 0 | 放出熱量c kJ |
下列敘述正確的是 ( )。
A.達平衡時氨氣的體積分數:①>③
B.三個容器內反應的平衡常數:③>①>②
C.放出熱量關系:a < b <92.4
D.H2的轉化率:①> ②> ③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應![]() 在一個密閉容器中進行,下列措施可以使反應速率增大的是( )
在一個密閉容器中進行,下列措施可以使反應速率增大的是( )
①增加少量![]() ②升高溫度③體積不變,再通入
②升高溫度③體積不變,再通入![]() ④縮小體積增大壓強⑤體積不變,再通入He⑥壓強不變,再通入He
④縮小體積增大壓強⑤體積不變,再通入He⑥壓強不變,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com