
【題目】苯乙酸銅是合成優良催化劑、傳感材料——納米氧化銅的重要前驅體之一。下面是它的一種實驗室合成路線:
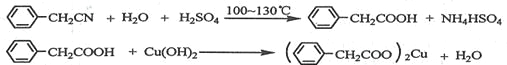
制備苯乙酸的裝置示意圖如下(加熱和夾持裝置等略):
已知:苯乙酸的熔點為76.5 ℃,微溶于冷水,溶于乙醇。
回答下列問題:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸時,加入蒸餾水與濃硫酸的先后順序是
__________________________。
(2)將a中的溶液加熱至100 ℃,緩緩滴加40 g苯乙腈到硫酸溶液中,然后升溫至130 ℃繼續反應。在裝置中,儀器b的作用是_____________________;儀器c的名稱是______________,其作用是___________________________________________。
反應結束后加適量冷水,再分離出苯乙酸粗品。加人冷水的目的是____________。下列儀器中可用于分離苯乙酸粗品的是________________(填標號)。
A.分液漏斗 | B.漏斗 | C.燒杯 | D.直形冷凝管E.玻璃棒 |
(3)提純粗苯乙酸的方法是_____________,最終得到44 g純品,則苯乙酸的產率是________。
(4)用CuCl2 2H2O和NaOH溶液制備適量Cu(OH)2沉淀,并多次用蒸餾水洗滌沉淀,判斷沉淀洗干凈的實驗操作和現象是____________________________________________。
(5)將苯乙酸加人到乙醇與水的混合溶劑中,充分溶解后,加入Cu(OH)2攪拌30min,過濾,濾液靜置一段時間,析出苯乙酸銅晶體,混合溶劑中乙醇的作用是___________________。
【答案】先加水、再加入濃硫酸 滴加苯乙腈 球形冷凝管 回流(或使氣化的反應液冷凝) 便于苯乙酸析出 BCE 重結晶 95% 取少量洗滌液、加人稀硝酸、再加AgN03溶液、無白色渾濁出現 增大苯乙酸溶解度,便于充分反應
【解析】
⑴蒸餾水與濃硫酸混合應先加水、再加入濃硫酸,防止暴沸。
⑵儀器b為分液漏斗,通過分液漏斗向三口瓶a中滴加苯乙腈;儀器c為球形冷凝管,能起到冷凝回流的作用(使氣化的反應液冷凝);反應結束后加適量冷水,便于苯乙酸(微溶于冷水)結晶析出,通過過濾能從混合液中分離出苯乙酸粗品,過濾所用的儀器主要有漏斗、玻璃棒、燒杯等。
⑶將粗苯乙酸晶體重新在熱水中溶解,然后再降溫結晶過濾(重結晶)可得較純凈的苯乙酸晶體;根據“1![]() ~1
~1![]() ”關系式,可計算苯乙酸的產率=
”關系式,可計算苯乙酸的產率=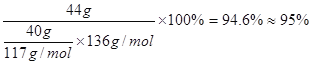 。
。
⑷在制備Cu(OH)2沉淀的同時還有可溶性NaCl生成,故判斷沉淀洗干凈的方法就是檢驗最后一次洗滌液中是否還含有Cl-。
⑸根據“苯乙酸微溶于冷水,溶于乙醇”,故乙醇與水的混合溶劑中的乙醇能增大苯乙酸的溶解度,便于充分反應。


科目:高中化學 來源: 題型:
【題目】實驗室用環己醇脫水的方法合成環己烯,該實驗的裝置如下圖所示:

可能用到的有關數據如下:
相對分子質量 | 密度/(g·cm-3) | 沸點/℃ | 溶解性 | |
環已醇 | 100 | 0.9618 | 161 | 微溶于水 |
環已烯 | 82 | 0.8102 | 83 | 難溶于水 |
按下列實驗步驟回答問題:
Ⅰ.產物合成
在a中加入10.0g環己醇和2片碎瓷片,冷卻攪拌下慢慢加入1mL濃硫酸,b中通入冷卻水后,開始緩慢加熱a,控制餾出物的溫度接近90℃。
(l)碎瓷片的作用是________;b的名稱是________;
(2)a中發生主要反應的化學方程式為____________________________;本實驗最容易產生的有機副產物的結構簡式為________。
Ⅱ.分離提純
將反應粗產物倒入分液漏斗中,依次用少量5%碳酸鈉溶液和水洗滌,分離后加人無水氯化鈣顆粒,靜置一段時間后棄去氯化鈣,最終通過操作X得到純凈的環己烯,稱量,其質量為4.1g。
(3)用碳酸鈉溶液洗滌的作用是________,操作X的名稱為________。
Ⅲ.產物分析及產率計算
(4)①核磁共振氫譜可以幫助鑒定產物是否為環己烯,環己烯分子中有_______種不同化學環境的氫原子。
② 本實驗所得環己烯的產率是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用CO與H2合成甲醇,CO(g)+2H2(s)![]() CH3OH(g) △H=—90.8kJ/mol。300℃時,在容積相同的3個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下
CH3OH(g) △H=—90.8kJ/mol。300℃時,在容積相同的3個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下
容量 | 甲 | 乙 | 丙 | |
反應物投入量 | 1 molCO、2molH2 | 1mol CH3OH | 2mol CH3OH | |
平衡時數據 | CH3OH的濃度(mol/L) | c1 | c2 | c3 |
反應的能量變化 | a kJ | b kJ | c kJ | |
體系壓強(Pa) | P1 | P2 | P3 | |
反應物轉化率 | a1 | a2 | a3 | |
下列說法正確的是
A.2c1>c3B.a+b<90.8C.2P2<P3D.a1+a3<1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是 ( )
A.氫氣的燃燒熱為 △H =-285.5 kJ·mol-1,則電解水的熱化學方程式為2H2O(1)![]() 2H2(g)+O2(g) △H =+285.5 kJ·mol-1
2H2(g)+O2(g) △H =+285.5 kJ·mol-1
B.密閉容器中,9.6 g硫粉與11.2 g鐵粉混合加熱生成硫化亞鐵17.6 g時,放出19.12 kJ熱量,則Fe(s)+S(s) ===FeS(s) △H =-95.6 kJ·mol-l
C.500℃、30 MPa下,將0.5 mol N2和1.5 mol H2置于密閉的容器中充分反應生成NH3(g),放熱19.3 kJ,其熱化學方程式為N2 (g)+3H2 (g) ![]() 2NH3 (g)△H =-38.6 kJ·mol-l
2NH3 (g)△H =-38.6 kJ·mol-l
D.相同條件下,在兩個相同的恒容密閉容器中,1 mol N2和3 mol H2反應放出的熱量與2 mol NH3分解吸收的熱量一定一樣多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化鋁(Al2O3) 和氮化硅(Si3N4)是優良的高溫結構陶瓷,在工業生產和科技領域有重要用途。
(1)Al與NaOH溶液反應的離子方程式為_____________________________________。
(2)下列實驗能比較鎂和鋁的金屬性強弱的是____________(填序號)。
a.測定鎂和鋁的導電性強弱
b.測定等物質的量濃度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/L AlCl3和0.1 mol/L MgCl2中加過量NaOH溶液
(3)鋁熱法是常用的金屬冶煉方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 = -521 kJ/mol
Al與MnO2反應冶煉金屬Mn的熱化學方程式是_____________________________。
(4)工業上用化學氣相沉積法制備氮化硅,其反應如下:
3SiCl4(g) + 2N2(g) + 6H2(g) ![]() Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某溫度和壓強條件下,分別將0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密閉容器內,進行上述反應,5min達到平衡狀態,所得Si3N4(s)的質量是5.60g。
①H2的平均反應速率是_________ mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不斷擴大加料,SiCl4(g)的轉化率應______(填“增大”、“減小”或“不變”)。
(5)298K時,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度積表達式為Ksp=_______________。
為了使溶液中Ce4+沉淀完全,即殘留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需調節pH為______以上。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在相同溫度和體積下,對反應![]()
![]()
![]() 進行甲、乙、丙、丁四組實驗,實驗起始時放入容器內各組分的物質的量見下表
進行甲、乙、丙、丁四組實驗,實驗起始時放入容器內各組分的物質的量見下表
物質的量 |
|
|
|
|
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四種情況達到平衡后,![]() 最大的是
最大的是![]()
A.甲B.乙C.丙D.丁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵粉與水蒸氣反應的裝置如圖所示,有關該反應的說法正確的是( )
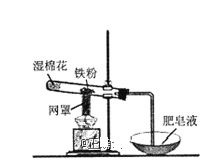
A.該反應屬于復分解反應
B.網罩的作用是集中火焰,提高溫度
C.濕棉花的作用是給試管降溫,防止炸裂
D.鐵與水蒸氣在高溫下的反應產物為Fe2O3和H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,將 0.4 mol A(g)和 0.2 mol B (g)充入 10 L 的恒容密閉容器發生反應:2A(g)+B(g)xC(g)(x是化學計量數),達平衡時測得 C(g) 的濃度為 0.016mol/L,B(g)的物質的量為0.12mol。下列說法中不正確的是
A.x=2
B.達平衡時A的轉化率為40%
C.該溫度下該反應的化學平衡常數是K=12
D.反應前容器內的壓強與平衡后容器內的壓強之比為15:13
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸是重要的化工原料,工業制取硫酸最重要的一步反應為:2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0
2SO3(g) △H< 0
(1)為提高SO2的轉化率,可通入過量O2,用平衡移動原理解釋其原因:___________。
(2)某興趣小組在實驗室對該反應進行研究,部分實驗數據和圖像如下。
反應條件:催化劑、一定溫度、容積10 L
實驗 | 起始物質的量/mol | 平衡時SO3 物質的量/mol | ||
SO2 | O2 | SO3 | ||
ⅰ | 0.2 | 0.1 | 0 | 0.12 |
ⅱ | 0 | 0 | 0.2 | a |
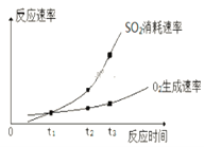
①實驗ⅰ中SO2的轉化率為______。
②a____0.12(填“>”、“=”或“<”)。
③t1、t2、t3中,達到化學平衡狀態的是________。
④ t2到t3的變化是因為改變了一個反應條件,該條件可能是___________。
(3)將SO2和O2充入恒壓密閉容器中,原料氣中SO2 和O2的物質的量之比m(m=n(SO2)/n(O2))不同時,SO2的平衡轉化率與溫度(T)的關系如下圖所示,則m1、m2、m3的大小順序為_____。
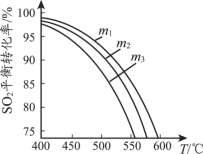
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com