
| 實驗 編號 | 實驗目的 | T/K | 催化劑用量/g | c/mol•l-1 | |
| KMnO4 | H2C2O4 | ||||
| Ⅰ | 為以下實驗作參考 | 298 | 0.5 | 0.01 | 0.1 |
| Ⅱ | 探究KMnO4酸性溶液的濃度對該反應速率的影響 | 298 | 0.5 | 0.001 | 0.1 |
| Ⅲ | 323 | 0.5 | 0.01 | 0.1 | |
| Ⅳ | 探究催化劑對反應速率的影響 | 0.1 | |||
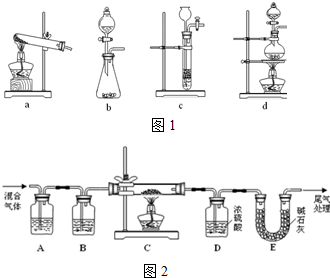
分析 (1)根據題中信息:草酸在濃硫酸并加熱條件下容易脫去水分,分解為二氧化碳和一氧化碳寫出反應的化學方程式;根據該反應反應物、反應條件進行分析合理的發生裝置;
(2)①草酸分解產物中有二氧化碳、一氧化碳和水,要得到干燥、純凈的CO氣體,應該先除去二氧化碳,然后使用濃硫酸進行干燥;
②該實驗裝置連有多個裝置,實驗前需要檢驗裝置的氣密性(或一氧化碳為可燃性氣體,點燃酒精燈之前需要將裝置中的空氣排凈,避免發生爆炸);
③結合方程式,根據固體減少的質量與濃硫酸增重的質量列關系式計算n值;
④設剩余固體質量為xg、裝置D增重yg,則
Fe2O3.nH2O+3CO=Fe+3CO2+nH2O 固體減少的質量為
18n (18n+48)g
y 10-x
$\frac{(18n+48)g}{18ng}$=$\frac{10-y}{y}$,整理可得:1+$\frac{24}{9n}$=$\frac{10-y}{y}$,
即固體剩余質量越大,測定的n值越大;裝置D中質量增重越大,測定的n值越小,據此進行判斷;
(3)①研究影響反應速率的因素時,除了待探究的因素不同外,其它因素必須完全相同,據此進行解答;
②因顏色是由KMnO4產生,如果想通過直接觀察褪色時間長短來判斷必須保證高錳酸鉀的體積與濃度相同,草酸的體積相同、濃度不同.
③高錳酸鉀溶液氧化草酸為二氧化碳,本身被還原為錳離子,結合原子守恒和電荷守恒配平得到離子方程式.
解答 解:(1)草酸在濃硫酸并加熱條件下容易脫去水分,分解為二氧化碳和一氧化碳,發生反應的化學方程式為:H2C2O4 $\frac{\underline{\;濃硫酸\;}}{△}$CO↑+CO2↑+H2O;該反應需要加熱、還應該能夠控制反應開始和停止,綜合考慮可知裝置d可用于草酸分解制取氣體,
故答案為:H2C2O4 $\frac{\underline{\;濃硫酸\;}}{△}$CO↑+CO2↑+H2O;d;
(2)①為得到干燥、純凈的CO氣體,洗氣瓶A盛放的為氫氧化鈉溶液,用于除去混合氣體中的二氧化碳;裝置盛放干燥劑濃硫酸,目的為干燥CO,
故答案為:濃NaOH溶液;濃硫酸;
②實驗前需要檢查裝置氣密性是否良好,否則影響測定結果(或者一氧化碳為可燃性氣體,點燃酒精燈之前需要將裝置中的空氣排凈),
故答案為:檢查裝置氣密性(或先排盡裝置內空氣,以防止加熱時發生爆炸);
③由題意知,固體質量減少的量為水和氧的量,濃硫酸吸收的量為水,反應方程式為:
Fe2O3.nH2O+3CO=Fe+3CO2+nH2O 固體減少的質量為
18ng (18n+48)g
0.72g 10.00g-8.32g
則0.72g×(18n+48)g=18ng×( 10.00g-8.32g),
解得n=2,
故答案為:2;
④設剩余固體質量為xg、裝置D增重yg,則
Fe2O3.nH2O+3CO=Fe+3CO2+nH2O 固體減少的質量為
18n (18n+48)g
y 10-x
$\frac{(18n+48)g}{18ng}$=$\frac{10-y}{y}$,整理可得:1+$\frac{24}{9n}$=$\frac{10-y}{y}$,
即固體剩余質量越大,測定的n值越大;裝置D中質量增重越大,測定的n值越小
a.缺少洗氣瓶B,會導致D中濃硫酸增重質量偏大,計算出的n值偏大,故a正確;
b.缺少裝置E,濃硫酸具有吸水性,會導致裝置D中的質量比實際增加的質量偏高,計算出的n偏大,故b正確;
c.反應后固體是鐵和少量Fe2O3,氧化鐵沒有完全反應,導致測定結果偏高,故c正確;
d.反應后固體是鐵和少量Fe2O3•nH2O,相當于部分Fe2O3•nH2O沒有反應,不影響沉淀結果,故d錯誤;
故答案為:abc;
(3)①實驗③中反應條件與實驗①相比,只有溫度不同,實驗實驗③探究的是溫度對反應速率的影響;實驗④探究的是探究催化劑對反應速率的影響,所以實驗④中催化劑用量與反應①不同,則催化劑為0,其它條件必須完全相同,
故答案為:
| 實驗 編號 | 實驗目的 | T/K | 催化劑的 用量/g | C/(mol/L) | |
| KMnO4 | H2C2O4 | ||||
| ① | |||||
| ② | |||||
| ③ | 探究溫度對反應速率的影響 | ||||
| ④ | 298 | 0 | 0.01 | ||
| 實驗 編號 | 實驗目的 | T/K | 催化劑的 用量/g | C/(mol/L) | |
| KMnO4 | H2C2O4 | ||||
| I | |||||
| II | |||||
| III | 探究溫度對反應速率的影響 | ||||
| IV | 298 | 0.0 | 0.01 | ||
點評 本題考查了實驗基本操作、反應裝置的選擇,實驗測定物質成分的實驗方案的設計、影響化學反應速率的因素等知識,題目難度較大,注意根據反應物的狀態及反應條件選擇反應裝置,明確探究反應速率快慢的方法.


科目:高中化學 來源: 題型:解答題
 在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度升高,混合氣體的顏色變深.回答下列問題:
在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度升高,混合氣體的顏色變深.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 摩爾質量就等于該物質的相對分子質量或相對原子質量 | |
| B. | 硫酸的摩爾質量是98克 | |
| C. | 1molH2O的質量為18克 | |
| D. | 2molH2O的質量為18克 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵溶解,析出0.01molZn | |
| B. | 鐵溶解,析出銅,且溶液中不含有Fe3+ | |
| C. | 鐵溶解,析出0.01molCu | |
| D. | 鐵溶解,溶液中金屬陽離子只剩Fe2+和Zn2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強電解質溶液的導電性一定比弱電解質溶液的導電性強 | |
| B. | 強電解質都是離子化合物,而弱電解質都是共價化合物 | |
| C. | 強電解質的水溶液中不存在溶質分子 | |
| D. | 不同的弱電解質只要物質的量濃度相同,電離程度也相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Li、Be、B原子最外層電子數依次增多 | |
| B. | P、S、Cl元素最高正價依次升高 | |
| C. | Na、K、Rb第一電離能逐漸增大 | |
| D. | N、O、F電負性依次增大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com