
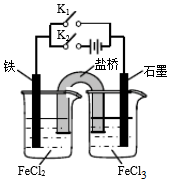
| A. | 閉合K1斷開K2,左側燒杯中的FeCl2溶液濃度逐漸增大 | |
| B. | 閉合K2斷開K1,左側燒杯中的Fe2+向鐵電極移動 | |
| C. | 閉合K1斷開K2,電流從石墨電極經過K1流向鐵電極 | |
| D. | 無論閉合K1斷開K2,還是斷開K1閉合K2,石墨電極上發生的反應都是Fe3++e-=Fe2+ |
分析 閉合K1上述裝置為原電池裝置,鐵為負極,鐵失電子生成亞鐵離子,鹽橋中氯子移向左側燒杯;
閉合K2,為電解池裝置,鐵為陽極,陽離子移向陰極,據此分析.
解答 解:A.閉合K1斷開K2,為原電池,鐵為負極,鐵失電子生成亞鐵離子,亞鐵離子濃度增大,鹽橋中氯子移向左側燒杯,氯離子濃度增大,故A正確;
B.閉合K2斷開K1,為電解池裝置,鐵為陽極,陽離子移向陰極,故B錯誤;
C.閉合K1斷開K2,為原電池,鐵為負極,電流從正極石墨經外電路流向鐵電極,故C正確;
D.閉合K1或閉合K2上述裝置分別是原電池和電解池,石墨電極分別為正極和陰極,石墨電極上發生還原反應,發生的反應都是Fe3++e-═Fe2+,故D正確;
故選B.
點評 本題考查了原電池和電解池的工作原理,把握電極反應和電極判斷以及電解質溶液變化是解題關鍵,側重考查學生的分析能力,題目難度不大.


科目:高中化學 來源: 題型:解答題
| 溫度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 銅平均溶解速率 (10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Mg2+、OH-、C1- | B. | Ba2+、K+、CO32-、NO3- | ||
| C. | Na+、K+、C1-、HCO3- | D. | H+、Na+、C1-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的量是國際單位制中七個基本物理量之一 | |
| B. | 物質的量表示含有一定數目粒子的集體 | |
| C. | 物質的量是國際單位制中的一個基本單位 | |
| D. | 摩爾是計量原子、分子或離子等微觀粒子的“物質的量”的單位 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2、O2、SO3中 | B. | SO3中 | C. | SO2、O2中 | D. | SO2、SO3中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
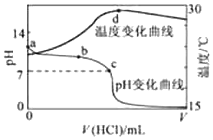 室溫下,將1.000mol•L-1鹽酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和溫度隨加入鹽酸體積變化曲線如圖所示.下列有關說法正確的是( )
室溫下,將1.000mol•L-1鹽酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和溫度隨加入鹽酸體積變化曲線如圖所示.下列有關說法正確的是( )| A. | a點由水電離出的c(H+)=1.0×10-14mol/L | |
| B. | b點:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | b點時加入的鹽酸體積小于20.00mL,而c點時加入的鹽酸體積大于20.00mL | |
| D. | d點后,溶液溫度略下降的主要原因是NH3•H2O電離吸熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 它們的體積之比為1:1 | B. | 它們所含氧原子數目之比為2:3 | ||
| C. | 它們的分子數目之比為1:1 | D. | 它們所含原子數目之比為3:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com