
框圖所示的轉化關系中,A、C均為常見的金屬單質,A、C在冷的H的濃溶液中均會發生鈍化;E為固體非金屬單質。B為紅色固體氧化物,X為常見的無色液體.L焰色為黃色,且能使酚酞變紅(反應過程中生成的水及其他產物已略去)
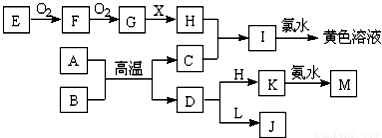
請回答以下問題:
(1)含碳量在0.03%~2%之間的C的合金,是目前世界上使用量最大的合金,這種合金是 ;
A.鋁合金 B.青銅 C.鎂合金 D.鋼鐵
(2)F的化學式為 ;
(3)K與氨水反應的離子方程式為 ;
(4)A與B生成C和D的反應是 (填“放出”或“吸收”)大量熱量的反應;
(5)D與L反應的離子方程式為 。
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2015-2016學年黑龍江省高二上期末化學試卷(解析版) 題型:選擇題
某有機物的結構如圖所示,下列說法正確的是

A.與乙苯互為同系物 B.分子中共直線的原子最多有4個
C.分子中共平面的碳原子最多有13個 D.與甲苯互為同分異構體
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省高三上學期第二次質檢化學試卷(解析版) 題型:選擇題
下列表示對應化學反應的離子方程式正確的是( )
A.Na2O2溶于水產生O2: 2O22-+2H2O=O2↑+4OH-
B.向氨水通入足量SO2:SO2十2NH3·H2O=2NH4++SO32-+H2O
C.次氯酸鈉與濃鹽酸反應產生Cl2:ClO-+Cl-+H2O=Cl2↑+2OH-
D.NaHCO3溶液與少量Ba(OH)2溶液反應:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖南省邵陽市高一上學期第三次月考化學試卷(解析版) 題型:填空題
A、B、C、D 4種元素,A元素所處的周期數、主族序數、原子序數均相等;B的原子半徑是其所在主族中最小的,B的最高價氧化物對應水化物的化學式為HBO3;C元素原子的最外層電子數比次外層少2個;C的陰離子與D的陽離子具有相同的電子排布,兩元素可形成化合物D2C。
(1)B元素的名稱為___________;B在周期表中的位置是第___________周期第___________族。
(2)C的元素符號為______________,C的最高價氧化物的化學式為__________________。
(3)D的最高價氧化物對應的水化物的化學式為______________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖南省邵陽市高一上學期第三次月考化學試卷(解析版) 題型:選擇題
等質量的鈉進行下列實驗,其中生成氫氣最多的是
A.將鈉投入到足量水中
B.將鈉用鋁箔包好并刺一些小孔,再放人足量的水中
C.將鈉放入足量稀硫酸中
D.將鈉放入足量稀鹽酸中
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山東省濟寧任城區高二上學期統考化學試卷(解析版) 題型:填空題
實施以減少能源浪費和降低廢氣排放為基本內容的節能減排政策,是應對全球氣
候問題、建設資源節約型、環境友好型社會的必然選擇。化工行業的發展必須符合國家節能減
排的總體要求。試運用所學知識,解決下列問題:
(1)已知某反應的平衡常數表達式為: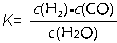 ,它所對應反應的化學方程式為 。
,它所對應反應的化學方程式為 。
(2)煤化工通常通過研究不同溫度下的平衡常數以解決各種實際問題。已知等體
積的一氧化碳和水蒸氣進入反應器時,會發生如下反應:
CO(g)+H2O(g)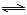 H2(g)+CO2(g)
H2(g)+CO2(g)
該反應的平衡常數隨溫度的變化如下表所示:
溫度/℃ | 400 | 500 | 800 |
平衡常數K | 9.94 | 9 | 1 |
①該反應的化學平衡常數表達式為K = 。
②該反應的正反應方向是 反應(填“吸熱”或“放熱”);
③若在500℃時進行,設CO和H2O的起始濃度均為0.020mol/L,在該條件下,CO的平衡轉化為 。
④800℃時,在固定容積的密閉容器中放入混合物,起始濃度為:c(CO)=0.01mol/L,c(H2O)=0.03mol/L,
c(CO2)=0.01mol/L,c(H2)=0.05mol/L,則反應開始時,H2O的消耗速率比生成速率 (填“大”、“小”或“不能確定”)。
(3)2SO2(g)+O2(g) 2SO3(g)反應過程中的能量變化如圖所示:
2SO3(g)反應過程中的能量變化如圖所示:

又已知1molSO2(g)氧化為1molSO3(g)的ΔH=-99 kJ·mol-1,
請回答下列問題:
 ①圖中E1、E2分別表示 、 ,E3的大小對該反應的反應熱 (填“有”或“無”)影響。該反應通常用V2O5作催化劑,加V2O5會使圖中B點 (填“升高”或“降低”)△H (填“變大”、“變小”或“不變”),理由是____________________。
①圖中E1、E2分別表示 、 ,E3的大小對該反應的反應熱 (填“有”或“無”)影響。該反應通常用V2O5作催化劑,加V2O5會使圖中B點 (填“升高”或“降低”)△H (填“變大”、“變小”或“不變”),理由是____________________。
 ②圖中△H= kJ·mol-1。
②圖中△H= kJ·mol-1。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山東省濟寧市高一上12月階段測化學試卷(解析版) 題型:計算題
將0.1 mol的鎂和鋁的混合物溶于50 mL 4 mol·L-1 H2SO4溶液中,然后再滴加
2 mol·L-1的NaOH溶液。請回答下列問題:

(1)若在滴加NaOH溶液的過程中,沉淀質量m隨加入NaOH溶液的體積V的變化如圖所示。當V1=80 mL時,計算金屬粉末中鎂的物質的量及V2的體積。
(2)若在滴加NaOH溶液的過程中,欲使Mg2+、Al3+剛好沉淀完全,計算滴入NaOH溶液的體積。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川省雅安市高一上學期12月月考化學試卷(解析版) 題型:選擇題
實驗室里利用以下反應制取少量氮氣:NaNO2+NH4Cl=NaCl+N2↑+2H2O。關于該反應的下列說法正確的是
A.NH4Cl中的氮元素被還原
B.每生成lmolN2轉移的電子的物質的量為6mol
C.NaNO2是氧化劑
D.N2既是氧化劑,又是還原劑
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省高二上12月月考化學試卷(解析版) 題型:選擇題
在北京奧運會期間,氫燃料電池公交汽車已經駛上北京街頭,體現“科技奧運,綠色奧運”。下列說法正確的
A.電解水制取氫氣是理想而經濟的制氫方法
B.發展氫燃料電池汽車不需要安全高效的儲氫技術
C.氫燃料電池把氫氣和氧氣燃燒放出的熱能轉化為電能
D.氫燃料電池汽車的使用可以有效減少城市空氣污染
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com