
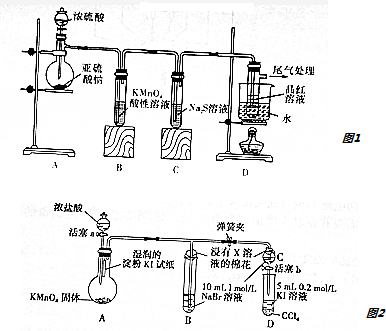
分析 Ⅰ.圖1分析可知:裝置A中濃硫酸和亞硫酸鈉反應生成二氧化硫,具有還原性,通過高錳酸鉀溶液使之褪色,二氧化硫也有氧化性,可以和硫化鈉發生反應,生成硫單質沉淀,最后二氧化硫氣體通入裝置D中的品紅試液,品紅褪色,剩余氣體進行尾氣處理,
(1)分析可知二氧化硫中硫元素化合價居于中間價態,既具有氧化性也具有還原性,特征性質是漂白性;
(2)二氧化硫是酸性氧化物和氫氧化鈉溶液反應生成亞硫酸鈉或亞硫酸鈉或二者混合物,當通入二氧化硫至溶液顯中性時,結合溶液中電荷守恒分析判斷;
Ⅱ.用如圖2所示裝置驗證鹵素單質氧化性的相對強弱,裝置A中生成氯氣,燒瓶上端濕潤的碘化鉀淀粉試紙變藍色,進入裝置B中的溴化鈉溶液呈橙紅色,氯氣氧化溴離子為溴單質,打開彈簧夾,打開活塞a,殫簧夾,滴加濃鹽酸,當B和C中的溶液變為黃色時,夾緊彈簧夾,當B中溶液由黃色變為棕紅色時,關閉活塞a,
(3)BC中棉花團的作用是吸收剩余的氯氣,用氫氧化鈉溶液;
(4)裝置A中產生氯氣是高錳酸鉀溶液和濃鹽酸反應生成氯化錳、氯化鉀、氯氣和水;
(5)過程Ⅲ實驗目的是確認C中的黃色溶液中無氯氣排除氯氣對溴置換碘實驗的干擾;
取溴化亞鐵溶液少許于試管中滴加2-3滴KSCN溶液,逐滴加入氯水,溶液出現紅色時,加入四氯化碳振蕩,四氯化碳層無明顯變化,繼續滴加氯水至過量,繼續振蕩靜置,四氯化碳層變橙紅色,據此判斷氧化性強弱;
解答 解:Ⅰ.圖1分析可知:裝置A中濃硫酸和亞硫酸鈉反應生成二氧化硫,具有還原性,通過高錳酸鉀溶液使之褪色,二氧化硫也有氧化性,可以和硫化鈉發生反應,生成硫單質沉淀,最后二氧化硫氣體通入裝置D中的品紅試液,品紅褪色,剩余氣體進行尾氣處理,
(1)裝置A中盛放濃硫酸儀器名稱是分液漏斗,裝置C中發生的現象是生成淡黃色沉淀,實驗分析可知二氧化硫中硫元素化合價居于中間價態,既具有氧化性也具有還原性,特征性質是漂白性,裝置B證明二氧化硫的還原性,裝置C證明二氧化硫的氧化性,裝置D證明二氧化硫的漂白性,選擇acd,
故答案為:分液漏斗;試管中出現淡黃色沉淀;acd;
(2)二氧化硫是酸性氧化物和氫氧化鈉溶液反應生成亞硫酸鈉或亞硫酸鈉或二者混合物,當通入二氧化硫至溶液顯中性時,結合溶液中電荷守恒為:c(H+)+c(Na+)=c(OH-)+2c(SO32-)+c(HSO3-),當通入二氧化硫至溶液顯中性時,此時溶液中c(Na+)=2c(SO32-)+c(HSO3-),
故答案為:2c(SO32-)+c(HSO3-);
Ⅱ.用如圖2所示裝置驗證鹵素單質氧化性的相對強弱,裝置A中生成氯氣,燒瓶上端濕潤的碘化鉀淀粉試紙變藍色,進入裝置B中的溴化鈉溶液呈橙紅色,氯氣氧化溴離子為溴單質,打開彈簧夾,打開活塞a,殫簧夾,滴加濃鹽酸,當B和C中的溶液變為黃色時,夾緊彈簧夾,當B中溶液由黃色變為棕紅色時,關閉活塞a,
(3)BC中棉花團的作用是吸收剩余的氯氣,用氫氧化鈉溶液,Cl2+2NaOH=NaCl+NaClO+H2O,
故答案為:NaOH;
(4)裝置A中產生氯氣是高錳酸鉀溶液和濃鹽酸反應生成氯化錳、氯化鉀、氯氣和水,反應的化學方程式為:2KMnO4+16HCl(濃)=2MnCl2+5Cl2↑+2KCl+8H2O,
故答案為:2KMnO4+16HCl(濃)=2MnCl2+5Cl2↑+2KCl+8H2O;
(5)過程Ⅲ當B中溶液由黃色變為棕紅色時,關閉活塞a,實驗目的是確認C中的黃色溶液中無氯氣排除氯氣對溴置換碘實驗的干擾,
故答案為:確認C中的黃色溶液中無氯氣排除氯氣對溴置換碘實驗的干擾;
設計實驗證明:氧化性強弱:Cl2>Br2>Fe3+,取溴化亞鐵溶液少許于試管中滴加2-3滴KSCN溶液,逐滴加入氯水,溶液出現紅色時,加入四氯化碳振蕩,四氯化碳層無明顯變化,繼續滴加氯水至過量,繼續振蕩靜置,四氯化碳層變橙紅色,據此判斷氧化性強弱,具體步驟為:取溴化亞鐵溶液少許于試管中滴加2-3滴KSCN溶液,逐滴加入氯水,溶液出現紅色時,加入四氯化碳振蕩,四氯化碳層無明顯變化,繼續滴加氯水至過量,繼續振蕩靜置,四氯化碳層變橙紅色,則說明氧化性強弱為:Cl2>Br2>Fe3+,
故答案為:取溴化亞鐵溶液少許于試管中滴加2-3滴KSCN溶液,逐滴加入氯水,溶液出現紅色時,加入四氯化碳振蕩,四氯化碳層無明顯變化,繼續滴加氯水至過量,繼續振蕩靜置,四氯化碳層變橙紅色,則說明氧化性強弱為:Cl2>Br2>Fe3+;
點評 本題考查了物質性質驗證的實驗設計、裝置連接的作用、試劑反應的現象、氧化還原反應原理的理解等知識點,注意知識的積累,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 加入的物質 | 結論 | |
| A | 50mL 1mol/L H2SO4 | 反應結束后,c(Na+)=c(SO42-) |
| B | 0.5mol CaO | 若反應完全后溶液的體積仍為100mL,則溶液的pH約為14 |
| C | 50mL H2O | c(Na+)=2[c(CO32-)+c(HCO3-)] |
| D | 0.1mol NaHSO4 | 反應完全后,溶液pH減小,c (Na+)不變 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用海水制取氯化鈉、燒堿、純堿、氯氣等物質都發生了氧化還原反應 | |
| B. | 蛋白質、葡萄糖、纖維素、油脂等都能在人體內水解并提供能量 | |
| C. | 為了提高生活用水的衛生標準,自來水廠常使用Cl2和CuSO3•5H2O進行消毒、凈化、以改善水質 | |
| D. | 塑料、合成橡膠和纖維這三大合成材料,都主要以石油、煤和天然氣為原料生產的 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 洗滌的目的一般是除去沉淀或晶體表面可溶性的雜質,提高純度 | |
| B. | 洗滌的試劑一般可選用蒸餾水、冰水、乙醇、該物質的飽和溶液 | |
| C. | 洗滌的操作是向過濾器里的固體加洗滌劑,使洗滌劑浸沒固體,待洗滌劑自然流下 | |
| D. | 洗凈的檢驗是檢驗最后一次洗滌液中是否含有形成沉淀的該溶液中的離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl2具有很強的氧化性,在化學反應中只能作氧化劑 | |
| B. | Cl-、Cl為不同的核素,有不同的化學性質 | |
| C. | 實驗室制備Cl2,可用排飽和食鹽水集氣法收集 | |
| D. | 電解飽和食鹽水制氯氣時,與電源負極相連的石墨棒上方充滿黃綠色氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
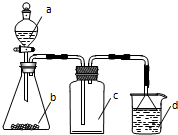 實驗室中某些氣體的制取、收集及尾氣處理裝置如圖所示(省略夾持和凈化裝置).用此裝置和表中提供的物質能完成相關實驗的是( )
實驗室中某些氣體的制取、收集及尾氣處理裝置如圖所示(省略夾持和凈化裝置).用此裝置和表中提供的物質能完成相關實驗的是( )| 選項 | a中物質 | b中物質 | c中的氣體 | d中物質 |
| A | 濃氨水 | CaO | NH3 | H2O |
| B | 稀硝酸 | Cu | NO | H2O |
| C | 硫酸 | Na2CO3 | CO2 | NaOH溶液 |
| D | 濃鹽酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com