
分析 (1)原子序數最小的元素為H,可形成H-離子,原子序數最大為O元素;
(2)形成的共價鍵中,單鍵含有1個共用電子對,雙鍵含有2個電子對,以此判斷;形成的穩定結構中,H的最外層電子數為2;
(3)實驗室用氫氧化鈣和氯化銨在加熱條件下反應制備氨氣;用碳酸鈣和稀鹽酸反應制備二氧化碳氣體;用鋅和稀硫酸反應制備氫氣,為加快反應速率,可形成原電池反應;
(4)n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(NaOH)=0.2L×1.5mol/L=0.3mol,發生2 CO2+3NaOH=Na2CO3+NaHCO3+H2O,結合放出的熱量計算反應熱,可寫出熱化學方程式.
解答 解:(1)原子序數最小的元素為H,可形成H-離子,電子式為[H:]-,原子序數最大為O元素,原子核外有2個電子層,最外層電子數為6,則位于周期表第2周期ⅥA族,
故答案為:[H:]-;第2周期ⅥA族;
(2)a.NH3含有3個N-H鍵,共用電子對數為3,b.CO2的結構式為O=C=O,共用電子對數為4,c.H2中含有H-H鍵,共用電子對數為1,d.H2O的結構式為H-O-H,含有2個共用電子對,則共用電子對數由少到多的順序是cdab,形成的穩定結構中,H的最外層電子數為2,則所有原子的最外層均達到8個電子穩定結構的物質是b,
故答案為:cdab;b;
(3)實驗室用氫氧化鈣和氯化銨在加熱條件下反應制備氨氣,方程式為2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,用碳酸鈣和稀鹽酸反應制備二氧化碳氣體,反應的離子方程式為CaCO3+2H++=Ca2++CO2↑+H2O,用鋅和稀硫酸反應制備氫氣,加入硫酸銅,鋅置換出銅,形成原電池反應,可加快反應速率,
故答案為:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;CaCO3+2H++=Ca2++CO2↑+H2O;構成原電池加快產生氫氣的速率;
(4)n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(NaOH)=0.2L×1.5mol/L=0.3mol,發生2 CO2+3NaOH=Na2CO3+NaHCO3+H2O,完全反應后放出QKJ的熱量,可知2mol CO2參加反應可放出10QkJ的熱量,故熱化學方程式為2 CO2(g)+3NaOH(aq)=Na2CO3(aq)+NaHCO3(aq)+H2O(l)△H=-10QKJ•mol-1,
故答案為:2 CO2(g)+3NaOH(aq)=Na2CO3(aq)+NaHCO3(aq)+H2O(l)△H=-10QKJ•mol-1.
點評 本題綜合考查元素的結構、位置以及性質等知識,為高頻考點,題目側重于學生的分析、計算能力的考查,注意把握核外電子排布以及熱化學方程式的書寫,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | ②③⑥ | B. | ③⑤ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
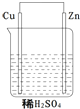 關于如圖所示的原電池下列敘述正確的是( )
關于如圖所示的原電池下列敘述正確的是( )| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 吸熱反應中,反應物的總能量大于生成物的總能量 | |
| B. | 形成化學鍵的過程會釋放能量 | |
| C. | 加熱才能發生的反應一定是吸熱反應 | |
| D. | 氧化反應均為吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 既能發生取代反應,也能發生加成反應 | |
| B. | 在濃硫酸催化下加熱脫水,可以生成不止一種四烯烴 | |
| C. | 1mol橙花醇與濃氫溴酸反應,最多消耗3mol HBr | |
| D. | 1mol橙花醇在室溫下與溴的四氯化碳溶液反應,最多消耗 480g Br2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 冰熔化時,分子中H-O鍵發生斷裂 | |
| B. | HI比HF易分解,是因為HI分子間不存在氫鍵 | |
| C. | 非極性鍵不可能存在于離子化合物中,由非金屬元素組成的化合物中一定不存在離子鍵 | |
| D. | 含有陰離子的物質一定含有陽離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 不可將水直接倒入濃硫酸中進行稀釋 | |
| B. | 濃硫酸可用于干燥O2、CO2 | |
| C. | 硝酸與鐵反應可產生H2 | |
| D. | 濃硫酸對皮膚或衣服有很強的腐蝕性 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com