
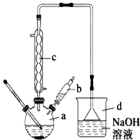
 溴苯是一種常用的化工原料.實驗室制備溴苯的實驗步驟如下:
溴苯是一種常用的化工原料.實驗室制備溴苯的實驗步驟如下:| 苯 | 溴 | 溴苯 | |
| 密度/gcm-3 | 0.88 | 3.10 | 1.50 |
| 沸點/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
 ;
;分析 (1)步驟1儀器a中,苯與液溴發生取代反應制備溴苯;
(2)由圖可知儀器c的名稱,儀器d為倒扣的漏斗,吸收氣體時可防止液體倒吸;
(3)將b中的液溴慢慢加入到a中,防止溴揮發;
(4)儀器c的作用是冷凝回流,使反應物盡可能充分反應;
(5)步驟4得到的粗產品中還含有雜質苯,由苯、溴苯的有關物理性質可知,則要進一步提純粗產品,利用互溶液體的沸點不同分離;
(6)實驗結束后,設計實驗方案檢驗d裝置所得溶液中含有Br-,需要硝酸、硝酸銀,生成淡黃色沉淀即可.
解答 解:(1)步驟1儀器a中,苯與液溴發生取代反應制備溴苯,反應為 ,
,
故答案為: ;
;
(2)由圖可知儀器c的名稱為冷凝管,儀器d的作用為吸收HBr防污染,防倒吸,
故答案為:冷凝管;吸收HBr防污染,防倒吸;
(3)將b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反應放出的熱使C6H6、Br2揮發而影響產率,
故答案為:防止反應放出的熱使C6H6、Br2揮發而影響產率;
(4)儀器c的作用是冷凝回流,使反應物盡可能充分反應,則回流的主要物質有C6H6、Br2,
故答案為:C6H6、Br2;
(5)步驟4得到的粗產品中還含有雜質苯,由苯、溴苯的有關物理性質可知,則要進一步提純粗產品,利用互溶液體的沸點不同分離,則還進行的實驗操作名稱是蒸餾,
故答案為:蒸餾;
(6)實驗結束后,設計實驗方案檢驗d裝置所得溶液中含有Br-,實驗操作為取少量d中溶液于試管中,滴加過量稀HNO3,再加入AgNO3溶液,現象和結論為有淡黃色沉淀生成,溶液中含有Br-,
故答案為:取少量d中溶液于試管中,滴加過量稀HNO3,再加入AgNO3溶液;有淡黃色沉淀生成,溶液中含有Br-.
點評 本題考查有機物的制備實驗,為高頻考點,把握制備實驗原理、實驗技能、混合物分離提純、離子檢驗等為解答的關鍵,側重分析與實驗能力的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 堿式滴定管只用水洗,而未用待測液潤洗 | |
| B. | 錐形瓶中殘留有蒸餾水 | |
| C. | 酸式滴定管滴定前尖嘴處有氣泡,滴定后氣泡消失 | |
| D. | 滴定前仰視刻度讀數,滴定后俯視刻度讀數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用標準FeCl3溶液滴定KI溶液,選擇KSCN溶液 | |
| B. | 用I2溶液滴定Na2SO3溶液,淀粉作指示劑 | |
| C. | 用AgNO3溶液滴定NaCl溶液,Na2CrO4作指示劑 | |
| D. | 用H2O2溶液滴定KI溶液,淀粉作指示劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
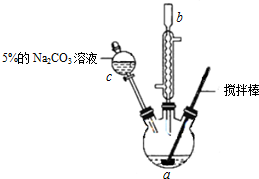
| 密度 | 沸點 | 溶解性 | ||
| 丙烯酸 | 1.05g/cm3 | 141℃ | 與水互溶,易溶于有機溶劑 | 有毒 |
| 甲醇 | 0.79g/cm3 | 64.7℃ | 與水互溶,易溶于有機溶劑 | 易揮發,有毒 |
| 丙烯酸甲酯 | 0.95g/cm3 | 80.5℃ | 難溶于水,易溶于有機溶劑 | 易揮發 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
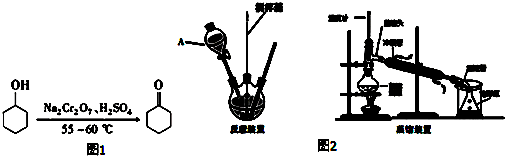
| 名稱 | 性狀 | 密度 | 溶點℃ | 沸點℃ | 溶解度 | |
| 水 | 乙醚 | |||||
| 環已醇 | 無色,有刺激性氣味 | 0.9624 | 25.93 | 161.5 | 5.67g/100mL | ∞ |
| 環已酮 | 無色,有刺激性氣味 | 0.9478 | - | 155.7 | 2.4g/100mL | ∞ |
 +1 Na2Cr2O7+4H2SO4→3
+1 Na2Cr2O7+4H2SO4→3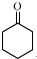 +1 Na2SO4+1 Cr2(SO4)3+7 H2O
+1 Na2SO4+1 Cr2(SO4)3+7 H2O查看答案和解析>>
科目:高中化學 來源: 題型:解答題
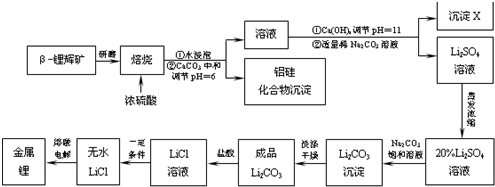
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 汽油失火時,立即用水滅火 | |
| B. | 實驗室不小心碰翻酒精燈引起實驗桌上灑落的少量酒精起火時,迅速用泡沫滅火器滅火 | |
| C. | 濃硫酸濺到皮膚上,立即用稀 NaOH 溶液洗滌 | |
| D. | 濃 NaOH 溶液濺到皮膚上,立即用水沖洗,然后涂上稀硼酸溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com