
為探究FeCl3溶液中的離子平衡和離子反應,某小組同學進行了如下實驗。
(1)配制50 mL 1.0 mol·L?1的FeCl3溶液,測其pH約為0.7,即c(H+) = 0.2 mol·L?1。
① 用化學用語解釋FeCl3溶液呈酸性的原因: 。
② 下列實驗方案中,能使FeCl3溶液pH升高的是 (填字母序號)。
a. 加水稀釋 b. 加入FeCl3固體
c. 滴加濃KSCN溶液 d. 加入NaHCO3固體
(2)小組同學利用上述FeCl3溶液探究其與足量鋅粉的反應。實驗操作及現象如下:
操作 | 現象 |
向反應瓶中加入6.5 g鋅粉,然后加入50 mL 1.0 mol·L?1的FeCl3溶液,攪拌 | 溶液溫度迅速上升,稍后出現紅褐色沉淀,同時出現少量氣泡;反應一段時間后靜置,上層溶液為淺綠色,反應瓶底部有黑色固體 |
收集檢驗反應過程中產生的氣體 | 集氣管口靠近火焰,有爆鳴聲 |
已知:Zn的性質與Al相似,能發生反應:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 結合實驗現象和平衡移動原理解釋出現紅褐色沉淀的原因: 。
② 用離子方程式解釋反應后溶液為淺綠色的原因: 。
③ 分離出黑色固體,經下列實驗證實了其中含有的主要物質。
i. 黑色固體可以被磁鐵吸引;
ii. 向黑色固體中加入足量的NaOH溶液,產生氣泡;
iii. 將ii中剩余固體用蒸餾水洗滌后,加入稀鹽酸,產生大量氣泡;
iv. 向iii反應后的溶液中滴加KSCN溶液,無變化。
a. 黑色固體中一定含有的物質是 。
b. 小組同學認為上述實驗無法確定黑色固體中是否含有Fe3O4,理由是 。
(3)為進一步探究上述1.0 mol·L?1 FeCl3溶液中Fe3+和H+氧化性的相對強弱,繼續實驗并觀察到反應開始時現象如下:
操作 | 現象 |
將5 mL 1.0 mol·L?1的FeCl3溶液與0.65 g鋅粉混合 | 溶液溫度迅速上升,開始時幾乎沒有氣泡 |
將 與0.65 g鋅粉混合 | 溶液中立即產生大量氣泡 |
小組同學得出結論:在1.0 mol·L?1 FeCl3溶液中,Fe3+的氧化性比H+更強。
 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源:2016-2017學年黑龍江、吉林省兩省六校高二上期中化學試卷(解析版) 題型:選擇題
一定溫度下,在恒容密閉容器中發生如下反應:2A(g)+B(g)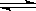 2C(g),若反應開始時充入2mol A和1mol B,達平衡后A的體積分數為a%。其他條件不變時,若按下列四種配比作為起始物質,平衡后A的體積分數仍為a%的是
2C(g),若反應開始時充入2mol A和1mol B,達平衡后A的體積分數為a%。其他條件不變時,若按下列四種配比作為起始物質,平衡后A的體積分數仍為a%的是
A.3mol C B.0.5mol A、1.5mol B和1.5molC
C.1mol B和1mol C D.1mol A、0.5mol B和1mol C
查看答案和解析>>
科目:高中化學 來源:2017屆甘肅省定西市通渭縣高三上學期期末化學試卷(解析版) 題型:選擇題
不同溫度下,水溶液中c(H+)與c(OH﹣)關系如圖所示.下列說法正確的是( )
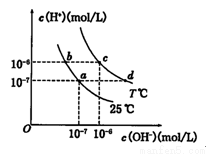
A.a點對應的溶液中大量存在:Na+、Mg2+、Cl﹣、SO42﹣
B.b點對應的溶液中大量存在:Fe2+、Ba2+、Cl﹣、NO3﹣
C.c點對應的溶液中大量存在:K+、Al3+、Cl﹣、CO32﹣
D.d點對應的溶液中大量存在:Na+、NH4+、ClO﹣、Cl﹣
查看答案和解析>>
科目:高中化學 來源:2017屆福建省高三上聯考二化學卷(解析版) 題型:選擇題
工業上用粗鹽(含Ca2+、Mg2+、SO42-等雜質)為主要原料采用“侯氏制堿法”生產純堿和化肥NH4Cl,工藝流程如下圖所示。下列有關說法正確的是
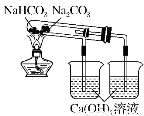
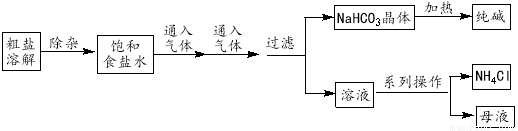
A.對粗鹽溶液除雜可依次加入NaOH、Na2CO3、BaCl2,再加入鹽酸調節溶液pH
B.飽和食鹽水中先通入的氣體為CO2
C.流程圖中的“系列操作”若在實驗室中進行,一定需要玻璃棒
D.如圖所示裝置可以比較Na2CO3和Na HCO3晶體的熱穩定性
HCO3晶體的熱穩定性
查看答案和解析>>
科目:高中化學 來源:2017屆福建省高三上聯考二化學卷(解析版) 題型:選擇題
下列說法正確的是
A.食用植物油屬于人體所需的三大營養物質之一
B.分餾、干餾都是物理變化,裂化、裂解都是化學變化
C.淀粉、蛋白質、葡萄糖都是高分子化合物
D.甲烷、汽油、生物柴油、酒精都是碳氫化合物,均可作為燃料
查看答案和解析>>
科目:高中化學 來源:2017屆北京市海淀區高三上學期期末化學試卷(解析版) 題型:選擇題
密閉容器中,由H2和CO直接制備二甲醚(CH3OCH3),其過程包含以下反應:
i.CO(g)+2H2(g) CH3OH(g) ∆H1=?90.1kJ·mol?1
CH3OH(g) ∆H1=?90.1kJ·mol?1
ii.2CH3OH(g) CH3OCH3(g)+H2O(g) ∆H2=?24.5kJ·mol?1
CH3OCH3(g)+H2O(g) ∆H2=?24.5kJ·mol?1
當其他條件相同時,由H2和CO直接制備二甲醚的反應中,CO平衡轉化率隨條件X 的變化曲線如右圖所示。下列說法正確的是
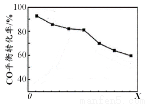
A . 由H2和CO直接制備二甲醚的反應為放熱反應
B. 條件X為壓強
C. X增大,二甲醚的產率一定增大
D. X增大,該反應的平衡常數一定減小
查看答案和解析>>
科目:高中化學 來源:2017屆北京市海淀區高三上學期期末化學試卷(解析版) 題型:選擇題
某同學進行SO2的性質實驗。在點滴板a、b、c處分別滴有不同的試劑,再向Na2SO3固體上滴加數滴濃H2SO4后,在整個點滴板上蓋上培養皿,一段時間后觀察到的實驗現象如下表所示。
序號 | 試劑 | 實驗現象 |
|
a | 品紅溶液 | 紅色褪去 | |
b | 酸性KMnO4溶液 | 紫色褪去 | |
c | NaOH溶液(含2滴酚酞) | 紅色褪去 |
下列說法正確的是
A. 濃硫酸與Na2SO3固體發生了氧化還原反應
B. a、b均表明SO2具有漂白性
C. c中只可能發生反應:SO2+ 2OH—= SO32—+ H2O
D. c中所得溶液的離子濃度一定存在關系:c(Na+)+c(H+) = 2c(SO32—) +c(HSO3?) + c(OH?)
查看答案和解析>>
科目:高中化學 來源:2017屆廣東省深圳市三校高三上學期第一次聯考化學卷(解析版) 題型:實驗題
利用鋁灰(主要成分為Al、Al2O3、AlN、FeO等)制備鋁鞣劑【主要成分為Al(OH)2Cl】的一種工藝如下:
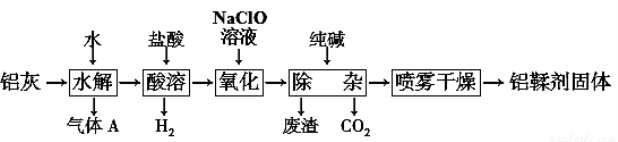
⑴氣體A能使濕潤的紅色石蕊試紙變藍。鋁灰在90 ℃水解生成A的化學方程式為: 。
⑵“酸溶”時,Al2O3發生反應的離子方程式為: 。
⑶“氧化”時,發生反應的離子方程式為: 。
⑷“廢渣”成分為________(填化學式)。
⑸采用噴霧干燥而不用蒸發的原因是______________________。
⑹煅燒硫酸鋁銨晶體,發生的主要反應為:
4[NH4Al(SO4)2·12H2O]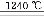 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O
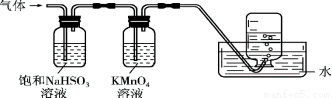
將產生的氣體通過如下圖所示的裝置。則集氣瓶中收集到的氣體是 (填化學式)。
查看答案和解析>>
科目:高中化學 來源:2017屆廣東省汕頭市高三上學期期末化學試卷(解析版) 題型:選擇題
設NA為阿伏伽德羅常數的數值,下列說法正確的是
A.34gH2O2中含有的陰離子數為1NA
B.4.6g乙醇中含有的C-H鍵的個數為0.6NA
C.標準狀況下,VL水含有的氧原子個數約為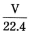
D.1molFe2+與足量的H2O2溶液反應,轉移NA個電子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com