
下圖是實驗室進行氯氣的制備及性質實驗的組合裝置,部分固定裝置未畫出。
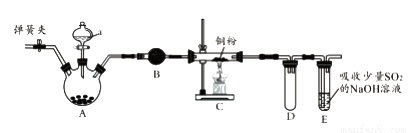
(1)A中固體是氯酸鉀,液體a是濃鹽酸,寫出該反應的化學方程式:_________________。
(2)B為干燥裝置,加入的固體是_________________;欲凈化氯氣,A、B間應添加一個盛有_________________的洗氣瓶。
(3)C中的反應現象是_________________;D的作用是_________________。
(4)已知E中發生的反應為:Cl2+Na2SO3+2NaOH 2NaCl+Na2SO4+H2O。E中吸收尾氣一段時間后,吸收液(強堿性)中肯定存在:Cl-、OH-和SO42-。某興趣小組認為該吸收液中還可能存在ClO-和SO32-。
2NaCl+Na2SO4+H2O。E中吸收尾氣一段時間后,吸收液(強堿性)中肯定存在:Cl-、OH-和SO42-。某興趣小組認為該吸收液中還可能存在ClO-和SO32-。
a.甲同學認為該吸收液中ClO-和SO32-不能同時存在,其理由是_________________(用離子方程式表示)。
b.乙同學為了檢驗吸收液中是否含有SO32-,取少量吸收液于試管中,加適量稀硫酸酸化后,滴加品紅溶液,發現品紅溶液褪色。據此推斷該吸收液中一定有SO32-。乙同學的推斷是否正確?________________(填“正確”或“不正確”),理由是_________________。
c.請設計實驗檢驗吸收液中是否含有ClO-_______________(寫出實驗步驟、現象和結論)。
科目:高中化學 來源:2017屆浙江省溫州市高三第二次選考模擬考試(2月)化學試卷(解析版) 題型:實驗題
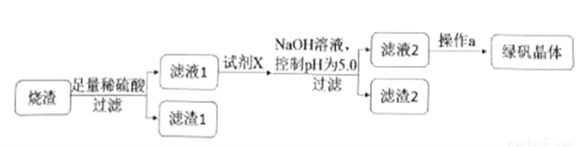
【加試題】乳酸亞鐵:{[CH3CH(OH)COO]2Fe·3H2O,M=288.0g/mol}是一中新型的優良補鐵劑,綠白色晶體,溶于水,幾乎不溶于乙醇。某研究性學習小組欲從硫鐵礦燒渣(主要成分為Fe2O3、SiO2、Al2O3)出發,先制備綠礬,再合成乳酸亞鐵。
已知:
①幾種金屬離子生成氫氧化物沉淀的PH(開始沉淀的PH按金屬離子濃度為1.0mol/L計算)。
金屬離子 | 開始沉淀的PH | 沉淀完全的PH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
②研究性學習小組設計的由燒渣制備綠礬晶體的操作流程如下:
③由綠礬(FeSO4·7H2O)制備乳酸亞鐵涉及下列反應:
FeSO4+Na2CO3=FeCO3↓+Na2SO4
2CH3CH(OH)COOH+FeCO3+2H2O [CH3CH(OH)COO]2Fe·3H2O+CO2↑。
[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
請回答:
(1)濾渣2的成分為__________(寫化學式)。
(2)操作a為蒸發濃縮、冷卻結晶、抽濾、洗滌、干燥。洗滌綠礬粗產品的具體操作為_______。
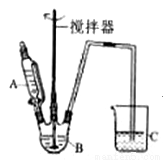
(3)據題干信息,欲制備較純凈的FeCO3時,某同學設計的實驗裝置示意圖如圖所示(夾持裝置省略)。儀器A 中存放的試劑為________,裝置C的作用為___________。
(4)在室溫下,將所得的乳酸亞鐵成品用無水乙醇進行浸泡2次,從而得到精制產品。選擇用無水乙醇進行浸泡的優點是___________(寫出兩點)。
(5)該學習小組同學用KMnO4滴定法測定樣品中Fe2+的量進而計算產品中乳酸亞鐵的純度,發現結果總是大于100%,其原因可能是___________。
經查閱文獻后,小組同學改用Ce(SO4)2標準溶液滴定進行測定。反應中Ce4+離子的還原產物為Ce3+。測定時,先稱取0.576g樣品,溶解后進行必要處理,用0.1000mol/L Ce(SO4)2標準溶液滴定至終點,記錄數據如下表。
滴定次數 | 0.1000mol/L Ce(SO4)2標準溶液體積/mL | |
滴定前讀數 | 滴定后讀數 | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
則產品中乳酸亞鐵的純度為________(以質量分數表示)。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省六校協作體高二下學期期初化學試卷 題型:選擇題
SF6是一種優良的絕緣氣體,分子結構中只存在S-F鍵。已知:1molS(s)轉化為氣態硫原子吸收能量280kJ,斷裂1molF-F 、S-F鍵需吸收的能量分別為160kJ、330kJ。則S(s)+3F2(g)=SF6(g)的反應熱△H為( )
A. -1780kJ/mol B. -1220 kJ/mol
C. -450 kJ/mol D. +430 kJ/mol
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省寶雞市高三教學質量檢測(一)理綜化學試卷(解析版) 題型:簡答題
工業上用硫鐵礦石(主要成分FeS2)在沸騰爐中焙燒,經過一系列反應,得到硫酸,焙燒后的礦渣用于煉鐵。其轉化過程如下圖所示(部分條件、反應物和產物已略去):
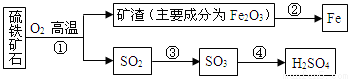
請回答下列問題:
(1)在上面轉化過程中,硫元素被氧化的反應是________(填反應編號)。
(2)寫出反應②中煉鐵的化學方程式_____________。若用1000t含雜質28%的礦渣煉鐵,理論上可得到含鐵96%的生鐵質量為_____________ t.
(3)寫出反應①的化學方程式 ,若有12.0g FeS2參加反應,則發生轉移的電子數為 。
(4)煙氣中SO2的排放會造成酸雨,工業上常用Na2SO3溶液來吸收SO2以減少對環境的危害。
①常溫下,將SO2通入一定體積的1.0mol·L-1Na2SO3溶液中,溶液pH不斷減小。當溶液pH約為6時,吸收SO2的能力顯著下降,此時溶液中c(SO32-)的濃度是0.2mol·L-1,則溶液中c(HSO3-)是 mol·L-1。用化學平衡原理解釋此時溶液顯酸性的原因 。
②向①中pH約為6時的吸收液中通入足量O2充分反應。取反應后溶液10mL與10mLBaCl2溶液混合,欲使混合時能生成沉淀,所用BaCl2溶液的濃度不得低于 mol·L-1。[已知25℃時,Ksp(BaSO3)=5.48×10-7, Ksp(BaSO4)= 1.08×10-10]
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省寶雞市高三教學質量檢測(一)理綜化學試卷(解析版) 題型:選擇題
化學與生產、生活密切相關,下列說法正確的是
A. 煤的干餾可得到煤油、石蠟和瀝青
B. 自來水廠可用明礬對水進行消毒殺菌
C. 氧化鋁可用來制造耐高溫的容器
D. 裝有硅膠的透氣袋可防止富含油脂的月餅被氧化
查看答案和解析>>
科目:高中化學 來源:2017屆安徽省A10聯盟高三下學期開年考試理綜化學試卷(解析版) 題型:選擇題
下圖是幾種常見有機物之間的轉化關系,有關說法正確的是( )
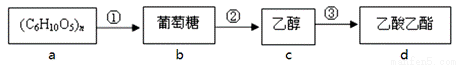
A. 有機物a只能是淀粉
B. 反應①、②、③均為取代反應
C. 有機物c可以使酸性高錳酸鉀溶液褪色
D. 有機物d的羧酸類同分異構體只有1種
查看答案和解析>>
科目:高中化學 來源:2016-2017學年廣東省汕頭市高一上學期期末考試化學試卷(解析版) 題型:選擇題
在Fe2(SO4)3溶液中,加入a g銅,完全溶解后,再加b g鐵,充分反應后得到c g殘余固體,且a>c,則下列說法正確的是
A. 殘余固體是銅和鐵
B. 最后得到的溶液中一定含有Cu2+
C. 將殘余固體加入到稀H2SO4中,有氣泡產生
D. 最后得到的溶液中可能含有Fe3+
查看答案和解析>>
科目:高中化學 來源:2016-2017學年廣東省汕頭市高一上學期期末考試化學試卷(解析版) 題型:選擇題
①漏斗 ②試管 ③蒸餾燒瓶 ④天平 ⑤分液漏斗 ⑥研缽
A. ①③④ B. ①②⑥ C. ①③⑤ D. ①③⑥
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省宜昌市高一上學期期末考試化學試卷(解析版) 題型:簡答題
(1)從氧化還原的角度分析水在下列化學反應中只做還原劑的是_______________
A電解水 B鈉和水的反應(2Na+2H2O===2NaOH+H2↑)
C氟氣和水反應(2F2+2H2O===4HF+O2) D氯氣和水反應(Cl2+H2O===HCl+HClO):
(2)某一反應體系中有反應物和生成物共5種物質:S、H2S、HNO3、NO、H2O。該反應物中還原產物是________;若反應方程式中轉移了0.4 mol電子,則氧化產物的質量是_____ g。
(3)將少量Cl2通入FeBr2的溶液中,反應的離子方程式為:2Fe2++Cl2===2Fe3++2Cl-,這個事實說明Fe2+、Cl-、Br—三種粒子還原性由強到弱的排列順序為:__________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com