
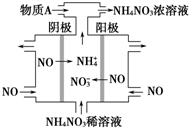
 2015年3月,全國“兩會”代表委員就我國“霧霾”治理積極建言獻策.科學家研究表明氮氧化物與懸浮在大氣中的鹽粒子相互作用時能產生“二次霧霾”,涉及的反應有:
2015年3月,全國“兩會”代表委員就我國“霧霾”治理積極建言獻策.科學家研究表明氮氧化物與懸浮在大氣中的鹽粒子相互作用時能產生“二次霧霾”,涉及的反應有:分析 (1)依據化學平衡常數概念,結合反應化學方程式書寫平衡常數,平衡常數等于生成物平衡濃度冪次方乘積除以反應物平衡濃度冪次方乘積;
(2)反應達到正逆反應速率相同,各組分含量保持不變,以及選項的分析判斷,原則為變量不變證明反應達到平衡狀態;
(3)①依據平衡三段式列式計算,依據反應速率概念計算V=$\frac{△c}{△t}$、轉化率概念的計算,轉化率=$\frac{消耗量}{起始量}$×100%;
②反應(Ⅱ)在恒壓條件下進行,隨反應進行,氣體體積減小,為保持恒壓所以容器體積減小,壓強比恒容容器大,平衡正向進行,平衡時NO的轉化率α2 增大;平衡常數隨溫度變化,不隨濃度、壓強變化,平衡常數隨溫度變化;
(4)工業上電解NO制備 NH4NO3,由裝置圖可知陽極發生氧化反應,NO被氧化生成NO3-,陰極發生還原反應,NO被還原生成NH4+,陽極反應為NO-3e-+2H2O=NO3-+4H+,陰極反應為:NO+5e-+6H+=NH4++H2O,結合電極方程式解答該題;
(5)根據物質的物質的量與熱量成正比計算費用焓變,結合熱化學方程式的書寫方法標注物質聚集狀態和對應反應的焓變書寫.
解答 解:(1)2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),固體不寫入平衡常數表達式,反應的平衡常數K1=$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$;
故答案為:$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$;
(2)恒溫恒容條件下,反應(Ⅱ)2NO(g)+Cl2(g)?2ClNO(g)是氣體體積減小的反應;
a.反應前后氣體物質的量減小,體系壓強保持不變,說明反應達到平衡狀態,故a正確;
b.平衡狀態氯氣是黃綠色氣體,混合氣體顏色保持不變說明反應達到平衡狀態,故b正確;
c.NO和ClNO的物質的量相等是反應的定量關系,在反應過程中和平衡狀態下和起始量有關,不能說明反應達到平衡狀態,故c錯誤;
d.每消耗0.1mol NO的同時消耗0.05mol Cl2,只能說明反應正向進行,不能說明正逆反應速率相同,故d錯誤;
故答案為:ab;
(3)①在恒溫條件下,向2L恒容密閉容器中加入0.2mol NO和0.1mol Cl2,10min時反應(Ⅱ)達到平衡,測得10min內v(ClNO)=7.5×10-3mol•L-1•min-1,物質的量為7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,
2NO(g)+Cl2(g)?2ClNO(g),
起始量(mol) 0.2 0.1 0
變化量(mol) 0.15 0.075 0.15
平衡量(mol) 0.05 0.025 0.15
則平衡后n(Cl2)=0.025mol,
NO的轉化率α1=$\frac{0.15mol}{0.2mol}$×100%=75%;
故答案為:75%;
②其他條件保持不變,反應(Ⅱ)在恒壓條件下進行,隨反應進行,氣體體積減小,為保持恒壓所以容器體積減小,壓強比恒容容器大,平衡正向進行,平衡時NO的轉化率α2 增大;平衡常數隨溫度變化,不隨濃度、壓強變化;
故答案為:>; 不變;
(4)電解NO制備NH4NO3,陽極反應為NO-3e-+2H2O=NO3-+4H+,陰極反應為:NO+5e-+6H+=NH4++H2O,從兩極反應可看出,要使得失電子守恒,陽極產生的NO3-的物質的量大于陰極產生的NH4+的物質的量,總反應方程式為:8NO+7H2O$\frac{\underline{\;通電\;}}{\;}$3NH4NO3+2HNO3,因此若要使電解產物全部轉化為NH4NO3,需補充NH3,
故答案為:NO+5e-+6H+═NH4++H2O; NH3;
(5)6.0g即0.1mol液態偏二甲肼與足量的液態四氧化二化氮完全反應生成N2(g)、CO2(g)、H2O(g)、放出225.0kJ的熱量,所以1mol液態偏二甲肼與足量的液態四氧化二化氮完全反應生成N2(g)、CO2(g)、H2O(g)、放出2250kJ的熱量,則熱化學方程式為:C2H8N2+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-2250kJ/mol;
故答案為:C2H8N2(l)+4NO2(l)═3N2(g)+2CO2(g)+4H2O(g)△H=-2250.0kJ/mol.
點評 本題考查了化學平衡常數、化學平衡標志的分析應用,化學平衡轉化率計算,影響化學平衡因素分析,原電池原理應用,熱化學方程式書寫方法,掌握基礎是關鍵,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 空氣質量與我們的健康息息相關,目我國通過檢測6項污染物的質量濃度來計算空氣質量指數(AQI),SO2、NO2、和CO是其中3項中的污染物.
空氣質量與我們的健康息息相關,目我國通過檢測6項污染物的質量濃度來計算空氣質量指數(AQI),SO2、NO2、和CO是其中3項中的污染物.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 上述反應達到平衡后,其他的條件不變的情況下,升高溫度,壓強一定增大 | |
| B. | 在上述平衡體系中再加入1molA和0.5molB,平衡正向移動,A的轉化率增大 | |
| C. | 該反應的熱化學方程式2A(g)+B(g)?C(g)+3D(l)+4E(g)△H=-QkJ/mol | |
| D. | 該反應在任何溫度下都可自發進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
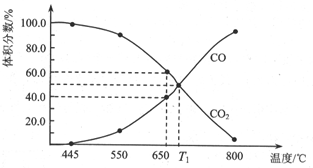 一定量的CO2與足量的C在恒容密閉容器中發生反應:C(s)+CO2(g)?2CO(g)△H.
一定量的CO2與足量的C在恒容密閉容器中發生反應:C(s)+CO2(g)?2CO(g)△H.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
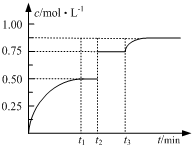 一定溫度下,將1mol A和1mol B氣體充入2L恒容密閉容器,發生反應:
一定溫度下,將1mol A和1mol B氣體充入2L恒容密閉容器,發生反應:| A. | 若t1=2,則反應在0~2 min內的平均速率為v(A)=0.50 mol•(L•min)-1 | |
| B. | 若t3時刻升高了溫度,則該反應的△H>0 | |
| C. | 若t1時刻后向體系中加入A、B、C各1 mol,則υ(正)>υ(逆) | |
| D. | 溫度不變,若起始向容器中加入1 mol A、1 mol B、2 mol D,則達平衡時A的轉化率小于50% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇轉化率通常不會超過1%,制約該反應走向工業化生產.
甲醇和CO2可直接合成DMC:2CH3OH(g)+CO2 (g)?CH3OCOOCH3 (g)+H2O(g),但甲醇轉化率通常不會超過1%,制約該反應走向工業化生產.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 任何溫度下反應均難以自發進行 | B. | 任何溫度下反應均可以自發進行 | ||
| C. | 僅常溫下反應可以自發進行 | D. | 僅高溫下反應可以自發進行 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com