
 一定量的CO2與足量的C在恒容密閉容器中發生反應:C(s)+CO2(g)?2CO(g)△H.
一定量的CO2與足量的C在恒容密閉容器中發生反應:C(s)+CO2(g)?2CO(g)△H.分析 (1)燃燒熱是1mol可燃物完全燃燒生成穩定氧化物放出的熱量,根據C和CO的燃燒熱書寫熱化學方程式,根據已知熱化學方程式構建目標方程式,根據蓋斯定律計算C(s)+CO2(g)?2CO(g)的△H;
(2)根據差量法求出生成的CO的物質的量,然后根據V=$\frac{△n}{\frac{v}{△t}}$求出反應的速率;
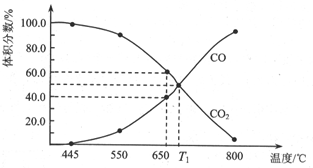
(3)①由圖可知,650℃時,反應達平衡后CO的體積分數為40%,設開始加入的二氧化碳為1mol,根據三段式進行計算;
②反應前壓強為ρkPa,分壓=總壓×物質的量分數,根據反應后的物質的量分數計算T1℃的平衡常數Kp,T1℃時Qp=Kp,平衡不移動;
③C(s)+CO2(g)?2CO(g),△v=氣態產物的化學計量數之和-氣態反應物的化學計量數之和=1,根據Kp=Kc(RT)△v,代入相關數據即可解得此時的熱力學溫度.
解答 解:(1)C和CO的燃燒熱分別為393KJ•mol-1、283KJ•mol-1,依據燃燒熱是1mol可燃物完全燃燒生成穩定氧化物放出的熱量,反應的熱化學方程式分別為:
①C(s)+O2(g)→CO2(g)△H=-393KJ/mol,②2CO(g)+O2(g)→2CO2(g)△H=-566KJ/mol,將①-②得到C(s)+CO2(g)?2CO(g),根據蓋斯定律
△H=(-393KJ/mol)-(-566KJ/mol)=+173KJ/mol,
故答案為:+173KJ/mol;
(2)假設體積為1L,測得容器內的密度增大了2.4g•L-1,C(s)+CO2(g)?2CO(g)△m
12 44 56 12
m 2.4g
$\frac{56}{m}=\frac{12}{2.4g}$ 解得m=11.2g,n=$\frac{m}{M}$=$\frac{11.2g}{28g/mol}$=0.4mol,則10s內用CO表示的平均反應速率為V=$\frac{△n}{\frac{v}{△t}}$=$\frac{0.4mol}{\frac{1L}{10S}}$=0.04mol/(L•s),
故答案為:0.04mol/(L•s);
(3)①由圖可知,650℃時,反應達平衡后CO的體積分數為40%,設開始加入的二氧化碳為1mol,轉化了xmol,
則有C(s)+CO2(g)?2CO(g)
開始 1 0
轉化 x 2x
平衡 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=40%,解得x=0.25mol,則CO2的轉化率為:$\frac{0.25}{1}$×100%=25%,
故答案為:25%;
②若將反應容器改為容積可變的恒壓密閉容器,壓強為ρkPa,由圖可知,T1℃時,反應達平衡后CO和CO2的體積分數都為50%,分壓=總壓×物質的量分數,T1℃時平衡Kp=0.5ρkPa,由圖可知,T1℃時,反應達平衡后CO和CO2的體積分數都為50%為平衡狀態,該溫度下達平衡后若再充入等物質的量的CO和CO2氣體,Qp=Kp,則平衡不移動,
故答案為:0.5pka;不;Qp=Kp;
③C(s)+CO2(g)?2CO(g),△v=氣態產物的化學計量數之和-氣態反應物的化學計量數之和=2-1=1,Kp=Kc(RT)△v,其中R=8.314L•kPa•mol-1•K-1,$\frac{{K}_{p}}{{K}_{c}}$的值為9976.8,△v=1,分別代入得:Kp=$\frac{9976.8}{8.314}$=1200,
故答案為:1200.
點評 本題考查了化學平衡的計算、閱讀題目獲取信息的能力等,需要學生具備運用信息與基礎知識分析問題、解決問題的能力,題目難度中等,明確圖象曲線變化的含義為解答關鍵,注意掌握化學平衡及其影響因素,試題培養了學生的分析能力及靈活應用能力.


 新活力總動員暑系列答案
新活力總動員暑系列答案 龍人圖書快樂假期暑假作業鄭州大學出版社系列答案
龍人圖書快樂假期暑假作業鄭州大學出版社系列答案科目:高中化學 來源: 題型:選擇題
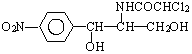 .此藥物分子中碳鏈末端羥基(-OH)中的氫原子換成來自棕櫚酸中的原子團
.此藥物分子中碳鏈末端羥基(-OH)中的氫原子換成來自棕櫚酸中的原子團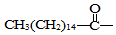 后,苦味消失,成為便于口服的無味氯霉素.以下關于無味氯霉素的敘述中正確的是( )
后,苦味消失,成為便于口服的無味氯霉素.以下關于無味氯霉素的敘述中正確的是( )| A. | 它是棕櫚酸的鹽類 | B. | 它不是棕櫚酸的酯類 | ||
| C. | 它的水溶性變差,所以苦味消失 | D. | 它的水溶性變良,所以苦味消失 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入碳酸鈉溶液產生白色沉淀,再加鹽酸,白色沉淀消失,一定有Ca2+ | |
| B. | 某溶液與NaOH溶液共熱,產生使濕潤紅色石蕊試紙變藍氣體,說明原溶液中存在NH4+ | |
| C. | 某溶液加入稀鹽酸產生無色氣體,將氣體通入澄清石灰水,溶液變渾濁,則一定含有CO32- | |
| D. | 加入氯化鋇溶液有白色沉淀產生,再加鹽酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH | B. | Ba(OH)2 | C. | AgNO3 | D. | HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 回收廢棄的飲料包裝紙,制作成公園內的休閑長椅 | |
| B. | 大力開發豐富的煤炭資源,減少對石油的依賴 | |
| C. | 在西部和沿海地區興建風力發電站,解決能源問題 | |
| D. | 鼓勵購買小排量汽車,推廣電動、混合動力汽車 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
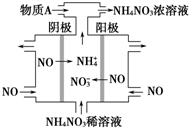 2015年3月,全國“兩會”代表委員就我國“霧霾”治理積極建言獻策.科學家研究表明氮氧化物與懸浮在大氣中的鹽粒子相互作用時能產生“二次霧霾”,涉及的反應有:
2015年3月,全國“兩會”代表委員就我國“霧霾”治理積極建言獻策.科學家研究表明氮氧化物與懸浮在大氣中的鹽粒子相互作用時能產生“二次霧霾”,涉及的反應有:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
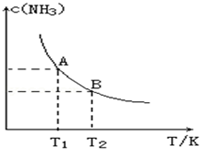 在一定條件下,將1.00molN2(g)與3.00molH2(g)混合于一個10.0L密閉容器中,在不同溫度下達到平衡時NH3(g)的平衡濃度如圖所示.其中溫度為T1時平衡混合氣體中氨氣的體積分數為25.0%.
在一定條件下,將1.00molN2(g)與3.00molH2(g)混合于一個10.0L密閉容器中,在不同溫度下達到平衡時NH3(g)的平衡濃度如圖所示.其中溫度為T1時平衡混合氣體中氨氣的體積分數為25.0%.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2Fe3++SO2+2H2O═SO42-+4H++2Fe2+ | B. | 2Br-+SO42-+4H+═SO2+Br2+2H2O | ||
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com