
【題目】高鐵酸鈉(Na2FeO4)是一種高效的飲用水處理劑,工業上可由下列方法制得:Fe2O3+3Na2O2![]() 2Na2FeO4+Na2O,下列關于該反應的說法中正確的是( )
2Na2FeO4+Na2O,下列關于該反應的說法中正確的是( )
A.反應中Na2O2既是氧化劑又是還原劑
B.Fe2O3可以通過鐵絲在氧氣中燃燒制得
C.生成1molNa2FeO4,有3mol電子轉移
D.在Na2FeO4中Fe為+4價,具有強氧化性,能殺菌消毒
 浙大優學小學年級銜接捷徑浙江大學出版社系列答案
浙大優學小學年級銜接捷徑浙江大學出版社系列答案科目:高中化學 來源: 題型:
【題目】下列事實與對應的方程式不符合的是
A.含20.0 g NaOH的稀溶液與稀鹽酸完全中和,放出28.7 kJ熱量,則稀醋酸和稀NaOH溶液反應的熱化學方程式為:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH>-57.4 kJ·mol-1
B.“NO2球”浸泡在冷水中,顏色變淺:2NO2(g)(紅棕色)![]() N2O4 (g)(無色) ΔH<0
N2O4 (g)(無色) ΔH<0
C.甲烷的燃燒熱為-890.3 kJ·mol—1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1
D.硫代硫酸鈉溶液與稀硫酸混合出現渾濁:S2O32-+2H+=S↓+SO2 ↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】時鐘反應或振蕩反應提供了迷人課堂演示實驗,也是一個活躍的研究領域.測定含![]() 濃度很小的碘化物溶液時,利用振蕩反應進行化學放大,以求出原溶液中碘離子的濃度.主要步驟是
濃度很小的碘化物溶液時,利用振蕩反應進行化學放大,以求出原溶液中碘離子的濃度.主要步驟是
①在中性溶液中,用溴將試樣中![]() 氧化成
氧化成![]() ,將過量的溴除去
,將過量的溴除去
②再加入過量的碘化鉀,在酸性條件下,使![]() 完全轉化成
完全轉化成![]()
③將②中生成的碘完全萃取后,用肼將其還原成![]() ,方程式為
,方程式為![]()
④將生成的![]() 萃取到水層后用
萃取到水層后用![]() 法處理
法處理
⑤將④得到的溶液加入適量的KI溶液,并用硫酸酸化
⑥將⑤反應后的溶液以淀粉作指示劑,用![]() 標準溶液滴定,方程式為:
標準溶液滴定,方程式為:![]()
經過上述放大后,則溶液中![]() 濃度放大為原溶液中
濃度放大為原溶液中![]() 濃度的(設放大前后溶液體積相等)
濃度的(設放大前后溶液體積相等)
A.2倍B.4倍C.6倍D.36倍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度時,向容積為 2 L 的密閉容器中充入一定量的 SO2(g)和 O2(g),發生反應:2SO2(g)+ O2(g)2SO3(g) △H = - 196 kJ/mol。一段時間后反應達到平衡狀態,反應過程中測定的部分數據如表所示。
反應時間/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列說法不正確的是
A.前 5 min 的平均反應速率為v(SO2) = 0.08 mol/(L·min)
B.保持溫度不變,向平衡后的容器中再充入 0.2 mol SO2(g)和 0.2 mol SO3(g)時, v正 > v逆
C.保持其他條件不變,若起始時向容器中充入 2 mol SO3(g),達到平衡狀態時吸收 78.4 kJ的熱量
D.相同條件下,起始時向容器中充入 1.5 mol SO3(g),達到平衡狀態時 SO3 的轉化率為 40%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組用下列裝置制備溴苯,下列說法錯誤的是

A. 裝置A中長玻璃導管僅起冷凝回流作用,裝置B中的實驗現象是CCl4由無色變橙色
B. 若裝置B后連接裝置C,裝置C中生成淡黃色沉淀,可證明裝置A中發生取代反應
C. 若裝置B后連接裝置D,則裝置D的作用是吸收尾氣
D. 向反應后的裝置A中加入NaOH溶液,振蕩靜置,下層為無色油狀液體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用化學用語表達。
(1)小蘇打受熱易分解,化學方程式為__。
(2)金屬鈉著火不能用水撲滅,用離子方程式解釋其原因__。
(3)工業上用氯氣和熟石灰制備漂白粉,化學方程式為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素![]() 、
、![]() 、
、![]() 在周期表中的相對位置如圖所示。已知
在周期表中的相對位置如圖所示。已知![]() 元素原子的外圍電子排布式為
元素原子的外圍電子排布式為![]() ,則下列說法不正確的是( )
,則下列說法不正確的是( )

A.![]() 元素原子的價電子排布式為
元素原子的價電子排布式為![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金屬元素最多
元素所在周期中所含非金屬元素最多
D.![]() 元素原子的核外電子排布式為
元素原子的核外電子排布式為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D四種元素,其原子序數依次增大,且質子數均小于18。A元素原子的最外層只有1個電子,該元素陽離子與N3-核外電子排布相同;B元素原子核外各軌道上均無成單電子;C元素原子的價電子排布為ns2np2;D-的核外電子構型與Ar相同。
(1)寫出A、C、D的元素符號:A________,C________,D________。
(2)寫出B元素電子的電子排布式________;D元素電子的電子排布圖______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車內燃機燃燒時,在高溫引發氮氣和氧氣反應會產生 NOx 氣體,NOx 的消除是科研人員研究的重要課題。
(1)通過資料查得 N2(g)+O2(g)2NO(g)△H反應溫度不平衡常數的關系如下表:
反應溫度/℃ | 1538 | 2404 |
平衡常數 |
|
|
則△H___________________0(填“<”“>”戒“=”)
(2)在 800℃時,測得 2NO(g)+O2(g) 2NO2(g)的反應速率不反應物濃度的關系如下表所示
初始濃度/ | 初始速率/ | |
C0(NO) | C0(O2) | |
0.01 | 0.01 |
|
0.01 | 0.02 |
|
0.03 | 0.02 |
|
已知反應速率公式為 V 正=K 正×c m(NO)cn(O2),則 m=___________________, K 正=___________________L2mol-2s-1
(3)在某溫度下(恒溫),向體積可變的容器中充人 NO2 氣體,發生反應 2NO2(g) N2O4(g),氣體分壓隨時間的變化關系如圖
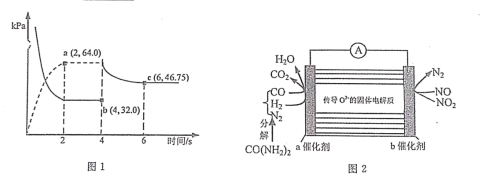
①該反應的壓力平衡常數 KP=___________________。
②4s 時壓縮活塞(活塞質量忽略不計)使容器體積變為原體積的 1/2,6s 時重新達到平衡,則P(N2O4)=___________________kPa。
(4)某學習小組利用圖 2 裝置探究向汽車尾氣中噴入尿素溶液處理氮的氧化物。則該裝置工作時,NO2 在 b 電極上的電極反應式為___________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com