
 反應過程的能量變化如圖所示。已知l mol SO2(g)氧化為1 molSO3 (g)的
反應過程的能量變化如圖所示。已知l mol SO2(g)氧化為1 molSO3 (g)的 。請回答下問題;
。請回答下問題;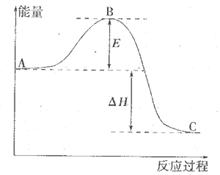
(1)E表示___________________;E的大小對該反應的反應熱__________(填“有”或“無”)影響。
(2)該反應通常用V2O5作催化劑,加V2O5會使圖中△H___________(填“變大”、“變小”或“不變”),理由是________。
(3)已知單質硫的燃燒熱為296 kJ·mol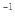 ,計算由S(s)生成2mol SO3(g)的△H =________________。
,計算由S(s)生成2mol SO3(g)的△H =________________。
(4)在一定條件下向容積為2L的容器中通入4molSO2和3molO2,充分反應達平衡后,SO3的體積分數為1/3。若在相同的條件下向容積為2L的容器中通入amolSO2和,bmolSO3,和cmol,反應向逆反應方向進行且達到平衡時SO3的體積分數也為1/3。則c的取值范圍為___________。
(1)活化能;無(2)不變;因為催化劑可以降低反應的活化能但不能改變反應物和生成物的總能量,故不改變反應熱;(3)-1185kJ/mol(4)2mol<c<4mol
解析試題分析:(1)根據能量變化圖可知,E表示正反應的活化能,而反應熱只與反應物和生成物的總能量有關,與活化能無關;(2)催化劑能夠降低反應的活化能但不能改變反應物的總能量,故△H的大小與是否使用催化劑無關;(3)因為單質硫的燃燒熱為296kJ?mol-1,熱化學方程式為①S(s)+O2(g)=SO2(g)△H=-296kJ?mol-1,②2SO2(g)+O2(g)=2SO3(g)△H=-198kJ?mol-1;依據蓋斯定律①×2+②得到 2S(s)+3O2(g)=2SO3(g)△H=-1185kJ/mol,即由S(s)生成2molSO3(g)的焓變為-1185kJ/mol;(4)利用等效平衡理論分析判斷。
考點:考查反應熱、蓋斯定律、等效平衡思想等相關知識。


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:單選題
化學反應H2+Cl2===2HCl的能量變化如圖所示,則下列說法正確的是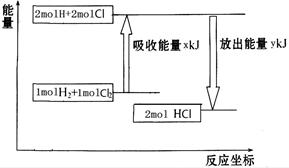
| A.該反應是放熱反應 |
| B.斷裂1 mol H—H鍵和1 mol Cl—Cl 鍵放出x kJ能量 |
| C.斷裂1 mol H—Cl鍵需要吸收y kJ的能量 |
| D.2 mol HCl的總能量高于1 mol H2和1 molCl2的總能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(4分)工業上常用天然氣作為制備甲醇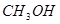 的原料。已知:
的原料。已知:
①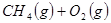
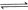
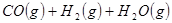
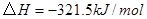
②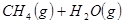
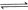
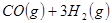
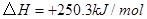
③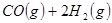
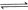
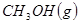
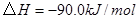
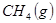 與
與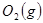 反應生成
反應生成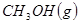 的熱化學方程式為 。
的熱化學方程式為 。
(2)向VL恒容密閉容器中充入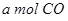 與
與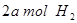 ,在不同壓強下合成甲醇。
,在不同壓強下合成甲醇。 的平衡轉化率與溫度、壓強的關系如下圖所示:
的平衡轉化率與溫度、壓強的關系如下圖所示: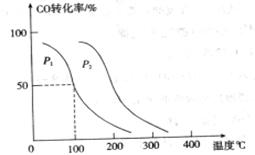
①壓強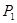
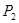 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在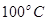 、
、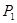 壓強時,平衡常數為 (用含
壓強時,平衡常數為 (用含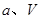 的代數式表示)。
的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(8分)(1)肼(N2H4)又稱聯氨,是一種可燃性的液體,可用作火箭燃料。已知在101kPa時,32.0gN2H4在氧氣中完全燃燒生成氮氣,放出熱量624kJ(25℃時),N2H4的燃燒熱化學方程式是 。
(2)肼—空氣燃料電池是一種堿性燃料電池,電解質溶液是20%~30%的KOH溶液。
肼—空氣燃料電池放電時:負極的電極反應式是 。
(3)電瓶車所用電池一般為鉛蓄電池,這是一種典型的可充電電池,電池總反應式為:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,充電時:陽極反應式: 用此裝置電解水和重水(D2O)組成的混合液(兩電極均是Pt),通電一段時間后,在兩極共收集到33.6 L(標準狀況)氣體,總質量為18.5 g,則混合氣體中H原子和D原子個數之比:
2PbSO4+2H2O,充電時:陽極反應式: 用此裝置電解水和重水(D2O)組成的混合液(兩電極均是Pt),通電一段時間后,在兩極共收集到33.6 L(標準狀況)氣體,總質量為18.5 g,則混合氣體中H原子和D原子個數之比:
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(本題16分)工業上利用CO2和H2在一定條件下反應合成甲醇。
(1)已知在常溫常壓下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
寫出甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式:____________ ________
(2)甲醇脫氫可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如下圖所示。回答下列問題:
HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如下圖所示。回答下列問題:
①脫氫反應的△H_____0,600K時,Y點甲醇的υ(正) _____υ(逆)(填“>”或“<”)
②從Y點到X點可采取的措施是_______________________________________________。
③有同學計算得到在t1K時,該反應的平衡常數為8.1mol·L-1。你認為正確嗎?請說明理由__________________________________________________________________________。
(3)納米級Cu2O由于具有優良的催化性能而受到關注。在相同的密閉容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分別進行催化CH3-OH的脫氫實驗:
CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的濃度(mol·L-1)隨時間t (min)變化如下表:
| 序號 | 溫度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)合成氨工業中氫氣可由天然氣和水反應制備,其主要反應為:
CH4(g)+ 2H2O(g) 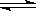 CO2(g)+4H2(g)
CO2(g)+4H2(g)
反應過程中能量變化如圖所示,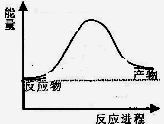
則該反應為 反應(填“吸熱”或“放熱”)
若已知,破壞1mol化學鍵需要吸收的熱量如下表所示:
| 化學鍵 | C—H | O—H | C=O | H—H |
| 吸收熱量(kJ/mol) | a | b | c | d |
 CO2(g)+4H2 (g)反應, 反應進行到4s時CO2的濃度為0.08mol/L,再過一段時間反應達平衡,平衡時容器的壓強是起始時的1.4倍。
CO2(g)+4H2 (g)反應, 反應進行到4s時CO2的濃度為0.08mol/L,再過一段時間反應達平衡,平衡時容器的壓強是起始時的1.4倍。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
CO是常見的化學物質,在工業生產中用途很廣泛。
(1) 已知:某些反應的熱化學方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
請寫出用CO除去空氣中SO2,生成S(g)及CO2熱化學方程式
(2) 某燃料電池以CO為燃料,以空氣為氧化劑,以熔融態的K2CO3為電解質,請寫出該燃料電池正極的電極反應式 ;
(3)在某溫度下、容積均為2L的三個密閉容器中,按不同方式投入反應物,保持恒溫恒容,使之發生反應:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料與各容器達到平衡時的有關數據如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料與各容器達到平衡時的有關數據如下:
| 實驗 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
| 平衡時n(CH3OH ) | 0.5mol | n2 | n3 |
| 反應的能量變化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 體系的壓強 | P1 | P2 | P3 |
| 反應物的轉化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)
Ⅰ.氯堿工業中常用離子交換膜法電解制堿(如圖1所示)。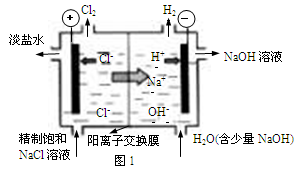
(1)寫出圖1中陰極的電極反應式 。
(2)已知陽離子交換膜只允許陽離子通過,陰離子交換膜只允許陰離子通過。工業上若用圖2裝置電解飽和Na2SO4溶液來生產純凈的NaOH和H2SO4,則該裝置最主要的缺陷是 。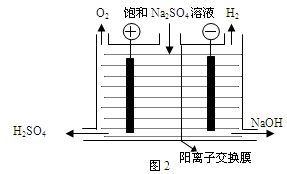
Ⅱ.輝鉬礦(MoS2)是一種重要的礦物。圖3是輝鉬礦多層焙燒爐的示意圖,其中1,2,3,…是爐層編號。580,600,610,…是各爐層的溫度(℃)。圖4給出了各爐層固體物料的物質的量百分含量。
已知:MoS2焙燒生成1molMoO3的反應熱△H1=-1011KJ/mol;MoO2氧化生成1molMoO3的反應熱△H2=-154KJ/mol。試回答: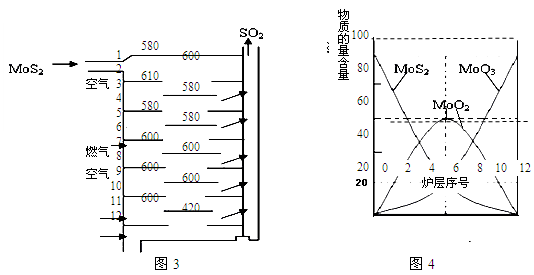
(1)驗證輝鉬礦焙燒生成的氣體是SO2而不是SO3的方法是 。
(2)輝鉬礦焙燒生成的氣體能使硫酸酸化的KMnO4溶液褪色,用化學方程式表示褪色的原因 。
(3)第6爐層存在的固體物質分別是MoS2、MoO3、MoO2,則它們的物質的量之比為 。
(4)圖4表明,中間爐層(4~6)可能存在一種“固體+固體→固體+…”的反應,請寫出該反應的熱化學反應方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氨的合成是最重要的化工生產之一。
I.工業上合成氨用的H2有多種制取的方法:
① 用焦炭跟水反應: C(s)+ H2O(g) CO(g)+ H2(g);
CO(g)+ H2(g);
② 用天然氣跟水蒸氣反應:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有關反應的能量變化如下圖,則方法②中反應的ΔH =__________ ___。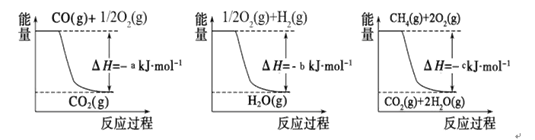
Ⅱ.在3個1L的密閉容器中,同溫度下、使用相同催化劑分別進行反應:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反應物,保持恒溫、恒容,反應達到平衡時有關數據為:
2NH3(g),按不同方式投入反應物,保持恒溫、恒容,反應達到平衡時有關數據為:
| 容 器 | 甲 | 乙 | 丙 |
| 反應物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 達到平衡的時間(min) | t | 5 | 8 |
| 平衡時N2的濃度(mol·L-1) | c1 | 3 | |
| N2的體積分數 | ω1 | ω2 | ω3 |
| 混合氣體密度(g·L-1) | ρ1 | ρ2 | |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com