
分析 A、B、C、D、E、F六種元素,它們的原子序數依次增大.A、E是同一主族的短周期元素,A原子最外層S能級和P能級軌道上的電子數相等,則A為碳元素,E為硅元素,C+與B2-具有相同的電子層結構,則C為鈉元素,B為氧元素,D原子的最外層電子數等于其電子層數,則D為鋁元素,A、B、C、D、E五種元素的原子序數之和是F元素原子序數的2倍,則F為26號元素,鐵元素,據此答題.
解答 解:A、B、C、D、E、F六種元素,它們的原子序數依次增大.A、E是同一主族的短周期元素,A原子最外層S能級和P能級軌道上的電子數相等,則A為碳元素,E為硅元素,C+與B2-具有相同的電子層結構,則C為鈉元素,B為氧元素,D原子的最外層電子數等于其電子層數,則D為鋁元素,A、B、C、D、E五種元素的原子序數之和是F元素原子序數的2倍,則F為26號元素,鐵元素,
(1)E為硅元素,元素E基態原子的電子排布式為1s22s22p6 3s2 3p2,
故答案為:1s22s22p6 3s2 3p2;
(2)B為氧元素,C為鈉元素,D為鋁元素,根據離子電子層數相同時,核電荷數越多,離子半徑越小,B、C、D三種元素形成簡單離子的半徑由大到小的順序是O2->Na+>Al3+,
故答案為:O2->Na+>Al3+;
(3)F為鐵元素,F元素在元素周期表中的位置是第四周期第VⅢ族,
故答案為:第四周期第VⅢ族;
(4)B為氧元素,E為硅元素,B、E兩種元素形成的化合物為二氧化硅,晶體類型為原子晶體,
故答案為:原子晶體;
(5)A為碳元素,B為氧元素,E為硅元素,C為鈉元素,D為鋁元素,由于非金屬性O>C>Si,金屬性Na>Al,根據元素周期律可知,電負性:A<B,氫化物的穩定性:B>E,第一電離能:C<D,最高價氧化物對應水化物的堿性C>D,
故答案為:<,>,<,>;
點評 本題考查了元素位置結構性質的相互關系及應用,根據原子結構確定元素,再結合物質的結構、性質來分析解答,解答時注意結合元素周期律分析問題,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| 元素代號 | L | M | Q | R | T |
| 原子半徑 | 0.160nm | 0.143nm | 0.112nm | 0.104nm | 0.066nm |
| 主要化合價 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氣態氫化物的還原性為H2T>H2R | B. | L2+與R2-的核外電子數相等 | ||
| C. | M與T形成的化合物不具有兩性 | D. | 單質與稀鹽酸反應的速率為L<Q |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 利用如圖所示裝置收集以下8種氣體(圖中燒瓶的位置不得變化):
利用如圖所示裝置收集以下8種氣體(圖中燒瓶的位置不得變化):查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| X | Y | Z | |
| A | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| B | KOH溶液 | SiO2 | 濃鹽酸 |
| C | O2 | N2 | H2 |
| D | FeCl3溶液 | Cu | 濃硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HBr、HCl、HF | B. | HF、H2O、NH3 | C. | NH3、PH3、H2S | D. | SiH4、CH4、NH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
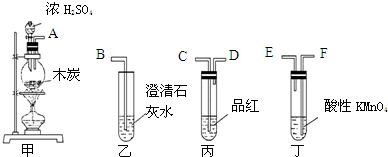
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬性保持不變 | B. | 非金屬性逐漸增強 | ||
| C. | 金屬性逐漸增強 | D. | 非金屬性保持不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
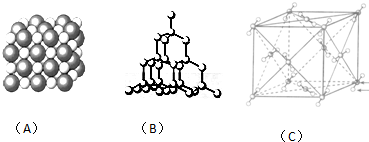
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com