
 實驗室制備1,2-二溴乙烷的反應原理如下:
實驗室制備1,2-二溴乙烷的反應原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | 一l30 | 9 | -1l6 |
分析 實驗室制備1,2-二溴乙烷的反應原理為:A裝置中乙醇發生消去反應生成乙烯:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(濃)}$CH2=CH2,B裝置可以作安全瓶,要以防倒吸,由于有副反應的發生,生成的乙烯中有酸性氣體,所以C裝置用氫氧化鈉吸收乙烯中的酸性雜質氣體,然后乙烯與溴發生加成反應生成1,2-二溴乙烷:CH2=CH2+Br2→BrCH2CH2Br,產物中混有的溴單質可以用氫氧化鈉溶液除去,
(1)乙醇在濃硫酸140℃的作用下發生分子間脫水;
(2)濃硫酸具有強氧化性,可能氧化乙醇中的碳;
(3)乙烯和溴水發生了加成反應;
(4)根據1,2-二溴乙烷和水的密度相對大小解答;
(5)Br2可以和氫氧化鈉發生氧化還原反應;
(6)利用1,2-二溴乙烷與乙醚的沸點不同進行解答.
解答 解:實驗室制備1,2-二溴乙烷的反應原理為:A裝置中乙醇發生消去反應生成乙烯:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(濃)}$CH2=CH2,B裝置可以作安全瓶,要以防倒吸,由于有副反應的發生,即濃硫酸具有強氧化性,將乙醇氧化成二氧化碳,自身被還原成二氧化硫,生成的乙烯中有二氧化碳、二氧化硫等酸性氣體,所以C裝置用氫氧化鈉吸收乙烯中的酸性雜質氣體,然后乙烯與溴發生加成反應生成1,2-二溴乙烷:CH2=CH2+Br2→BrCH2CH2Br,產物中混有的溴單質可以用氫氧化鈉溶液除去,
(1)乙醇在濃硫酸140℃的條件下,發生分子內脫水,生成乙醚,
故答案為:d;
(2)濃硫酸具有強氧化性,將乙醇氧化成二氧化碳,自身被還原成二氧化硫,二氧化碳、二氧化硫能和氫氧化鈉溶液反應,吸收酸性氣體的化學反應方程為CO2+2NaOH=Na2CO3+H2O、SO2+2NaOH=Na2SO3+H2O,
故答案為:c;CO2+2NaOH=Na2CO3+H2O、SO2+2NaOH=Na2SO3+H2O;
(3)乙烯和溴水發生加成反應生成1,2-二溴乙烷,1,2-二溴乙烷為無色,
故答案為:溴的顏色完全褪去;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,所以1,2-二溴乙烷在下層,
故答案為:下;
(5)常溫下Br2和氫氧化鈉發生反應:2NaOH+Br2═NaBr+NaBrO+H2O,
故答案為:b;
(6)1,2-二溴乙烷與乙醚的沸點不同,兩者均為有機物,互溶,用蒸餾的方法將它們分離,
故答案為:蒸餾.
點評 該題較為綜合,主要考查了乙醇制備1,2-二溴乙烷,掌握相關物質的基本化學性質,是解答本題的關鍵,平時須注意積累相關反應知識,難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)亞磷酸(H3PO3)是二元酸,與足量NaOH溶液反應,生成Na2HPO3,電解Na2HPO3溶液可得到亞磷酸,裝置示意圖如下:
(1)亞磷酸(H3PO3)是二元酸,與足量NaOH溶液反應,生成Na2HPO3,電解Na2HPO3溶液可得到亞磷酸,裝置示意圖如下:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 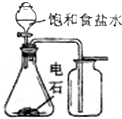 實驗室制備并收集乙炔 | B. | 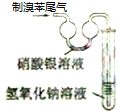 證明溴苯中含溴元素 | ||
| C. | 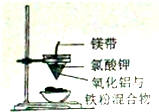 鋁熱反應 | D. | 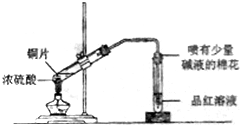 檢測銅與濃硫酸反應的氣體產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;| 密度(g/cm3) | 熔點(℃) | 沸點(℃) | 溶解性 | |
| 環已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 環已烯 | 0.81 | -103 | 83 | 難溶于水 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | B一定為固體 | B. | 平衡向右移動 | ||
| C. | 化學計量數:m+n大于或等于3 | D. | 物質C的體積分數減小 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com