
| 溫度/℃ | 10 | 30 | 60 | 90 |
| 濃度/mol•L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
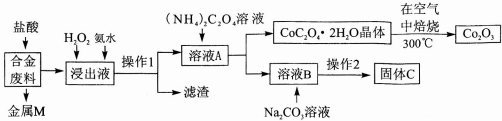
分析 合金廢料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活潑金屬)加入鹽酸過濾得到金屬M為不與鹽酸反應的銅,浸出液中加入過氧化氫氧化亞鐵離子為鐵離子,加入氨水調節溶液PH使鐵離子轉化為氫氧化鐵沉淀,通過操作Ⅰ過濾得到溶液A中加入草酸銨溶液沉淀鈷離子過濾得到溶液B主要是鋰離子的溶液,加入碳酸鈉沉淀鋰離子,過濾得到碳酸鋰;結晶析出CoC2O4•2H2O足量空氣煅燒得到氧化鈷;
(2)加入H2O2的作用是氧化亞鐵離子為鐵離子;加入氨水的作用是調節溶液PH使Fe3+轉化為Fe(OH)3沉淀;
(3)CoC2O4焙燒生成Co2O3、CO2和水;
(4)Li2CO3微溶于水,溶解度隨溫度升高而降低,為減少Li2CO3的溶解損失,蒸發濃縮后必須趁熱過濾,90℃時c(Li2CO3)的濃度為0.10mol/L,則c(Li+)=0.20mol/L,c(CO32-)=0.10mol/L,則Ksp(Li2CO3)=0.20×0.20×0.10=4.0×10-3;
(5)用惰性電極電解熔融Li2CO3制取鋰,陽極生成兩種氣體,應為二氧化碳和氧氣.
解答 解:合金廢料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活潑金屬)加入鹽酸過濾得到金屬M為不與鹽酸反應的銅,浸出液中加入過氧化氫氧化亞鐵離子為鐵離子,加入氨水調節溶液PH使鐵離子轉化為氫氧化鐵沉淀,通過操作Ⅰ過濾得到溶液A中加入草酸銨溶液沉淀鈷離子過濾得到溶液B主要是鋰離子的溶液,加入碳酸鈉沉淀鋰離子,過濾得到碳酸鋰;結晶析出CoC2O4•2H2O足量空氣煅燒得到氧化鈷,
(1)上述分析判斷金屬M為Cu,操作Ⅰ為過濾操作,故答案為:Cu;過濾;
(2)加入H2O2的作用是氧化亞鐵離子為鐵離子,反應的離子方程式為:2Fe2++H2O2+2H+=2Fe3++2H2O;加入氨水的作用是調節溶液PH使Fe3+轉化為Fe(OH)3沉淀,
故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O;調節溶液的pH使Fe3+轉化為Fe(OH)3沉淀;
(3)CoC2O4焙燒生成Co2O3、CO2和水,反應的化學方程式為4CoC2O4?2H2O+3O2$\frac{\underline{\;焙燒\;}}{\;}$2Co2O3+8 H2O+8CO2,
故答案為:4CoC2O4?2H2O+3O2$\frac{\underline{\;焙燒\;}}{\;}$2Co2O3+8 H2O+8CO2;
(4)Li2CO3微溶于水,溶解度隨溫度升高而降低,為減少Li2CO3的溶解損失,蒸發濃縮后必須趁熱過濾,90℃時c(Li2CO3)的濃度為0.10mol/L,則c(Li+)=0.20mol/L,c(CO32-)=0.10mol/L,則Ksp(Li2CO3)=0.20×0.20×0.10=4.0×10-3,
故答案為:減少Li2CO3的溶解損失;4.0×10-3;
(5)用惰性電極電解熔融Li2CO3制取鋰,陽極生成兩種氣體,應為二氧化碳和氧氣,電極方程式為2CO32--4e-=O2↑+2CO2↑,故答案為:2CO32--4e-=O2↑+2CO2↑.
點評 本題主要考查物質的分離提純的綜合應用,為高頻考點,側重于學生的分析能力和實驗能力、計算能力的考查,綜合性強,注意把握實驗的流程和原理,難度較大.


 金博士一點全通系列答案
金博士一點全通系列答案科目:高中化學 來源: 題型:填空題
 一定溫度下在體積為5L的密閉容器中發生可逆反應.
一定溫度下在體積為5L的密閉容器中發生可逆反應.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 負極反應Al-3e-Al3+ | B. | 燃料氣體是氧氣 | ||
| C. | 正極反應為2CO2+O2+4e-2CO32- | D. | 該電池不能用烴類物質作燃料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 磷酸燃料電池是目前較為成熟的燃料電池之一,其基本組成及反應原理如圖所示.下列說法不正確的是( )
磷酸燃料電池是目前較為成熟的燃料電池之一,其基本組成及反應原理如圖所示.下列說法不正確的是( )| A. | 該系統中不只存在化學能和電能的相互轉化 | |
| B. | 在移位反應器中,反應CO(g)+H2O(g)?CO2(g)+H2(g)(△H>0),若溫度越高,則v(CO)越大 | |
| C. | 改質器和移位反應器的作用是將CxHy轉化為H2和CO2 | |
| D. | 該電池正極的電極反應為O2+4H+-4e-═2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將CH3CH2Br與NaOH溶液共熱,冷卻,取上層溶液加AgNO3溶液,觀察是否產生淡黃色沉淀,檢驗CH3CH2Br與NaOH溶液是否發生反應 | |
| B. | 在實驗室,將乙醇和濃硫酸的混合物共熱發生反應,生成能使酸性KMnO4溶液褪色的氣體,此氣體一定是乙烯 | |
| C. | 室溫下向苯和少量苯酚的混合液中加入適量燒堿溶液,振蕩、靜置后分液,可除去其中的苯酚 | |
| D. | 將硝酸銀溶液和少量乙醛于試管中充分混合后,把試管放在熱水浴中加熱,在試管內壁上有光亮的銀鏡出現 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 開始沉淀時 | 3.4 | 6.3 | 1.5 |
| 完全沉淀時 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com