
| A. | 100mL pH=3的鹽酸和醋酸溶液,與足量鋅反應,起始時二者產生氫氣的速率基本相等 | |
| B. | 100mL 1mol/L的鹽酸和50mL 2mol/L的鹽酸分別與足量的鋅反應,二者放出氫氣的速率和質量均相等 | |
| C. | 100mL pH=3的鹽酸和醋酸溶液,與足量鋅反應后,所得氫氣的質量相等 | |
| D. | 100mL 0.1mol/L的硫酸和鹽酸溶液,與足量鋅反應后,前者放出氫氣的質量與后者相等 |
分析 A.反應速率與氫離子濃度成正比;
B.體積、濃度不同的鹽酸和足量Zn反應時,反應速率與氫離子濃度成正比,生成氫氣的量與酸的物質的量成正比;
C.pH、體積相等的醋酸和鹽酸分別和足量Zn反應時,生成氫氣的質量與酸的物質的量成正比;
D.硫酸和HCl都是強電解質,濃度、體積相等的硫酸和鹽酸分別與足量的Zn反應時,生成氫氣的質量與氫離子的物質的量成正比.
解答 解:A.反應速率與氫離子濃度成正比,pH相等的鹽酸和醋酸,溶液中氫離子濃度相等,所以其開始反應速率相等,故A正確;
B.體積、濃度不同的鹽酸和足量Zn反應時,反應速率與氫離子濃度成正比,所以鹽酸濃度越大時,其反應速率越大;生成氫氣的量與酸的物質的量成正比,100mL 1mol•L-1的鹽酸和50mL 2mol•L-1的鹽酸中HCl的物質的量相等,所以分別與足量的Zn反應時生成氫氣質量相等,故B錯誤;
C.醋酸和鹽酸都是一元酸,生成氫氣的質量與酸的物質的量成正比,pH、體積相等的醋酸和鹽酸分別和足量Zn反應時,醋酸的物質的量大于鹽酸,所以醋酸反應生成的氫氣質量多,故C錯誤;
D.硫酸和HCl都是強電解質,濃度、體積相等的硫酸和鹽酸分別與足量的Zn反應時,生成氫氣的質量與氫離子的物質的量成正比,由于硫酸電離出的氫離子的物質的量大于鹽酸溶液中氫離子的物質的量,所以硫酸生成氫氣的質量大,故D錯誤;
故選A.
點評 本題考查了弱電解質的電離,明確反應速率的影響因素、生成氫氣的量與酸物質的量的關系是解本題關鍵,注意:不同的酸與同種金屬反應時,其反應速率與氫離子濃度成正比,與酸的強弱、酸的物質的量無關,為易錯點,題目難度中等.


 本土教輔贏在暑假高效假期總復習云南科技出版社系列答案
本土教輔贏在暑假高效假期總復習云南科技出版社系列答案 暑假作業北京藝術與科學電子出版社系列答案
暑假作業北京藝術與科學電子出版社系列答案 第三學期贏在暑假系列答案
第三學期贏在暑假系列答案科目:高中化學 來源: 題型:選擇題
| A. | pH=1的溶液中:Na+、NH4+、SO42-、CO32- | |
| B. | 與鋁反應產生大量氫氣的溶液中:Ca2+、Fe2+、Cl-、NO3- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-6的溶液中:K+、Na+、I-,SO42- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液中:Na+、K+、S2-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
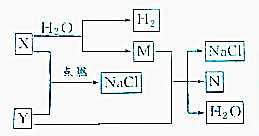 已知下列轉化關系:
已知下列轉化關系:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸式滴定管、堿式滴定管及錐形瓶均需洗凈后再潤洗內壁2~3次 | |
| B. | 應該選擇酚酞作指示劑 | |
| C. | 滴定過程中眼睛應始終注視滴定管內液面變化 | |
| D. | 讀取標準液的刻度時,滴定前平視,滴定后仰視,測定結果偏低 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑥⑧ | B. | ②④⑥⑦ | C. | ④⑤⑥⑧ | D. | ③⑥⑦⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蔗糖遇濃硫酸可發生碳化現象,但與稀硫酸則不會發生反應 | |
| B. | 因為纖維素結構中有羥基,所以它能與醋酸發生酯化反應,生成乙酸纖維素酯 | |
| C. | 除去淀粉中的葡萄糖雜質,可用加水滲析的方法 | |
| D. | 將淀粉與水在酸作用下加熱水解,在滴入碘酒不變藍時表示水解完全,即可停止加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 鉛蓄電池在放電過程中,電池反應液的pH將變小 | |
| B. | 相同條件下,結合質子的能力:OH->ClO->CH3COO- | |
| C. | 一定條件下,使用催化劑能加快反應速率并提高反應物的平衡轉化率,平衡常數保持不變 | |
| D. | 在氯化銀懸濁液中加入NaBr溶液,沉淀由白色轉變為淡黃色,說明Ksp(AgCl)>Ksp(AgBr) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com