
| ||
| ||
| ||
| ||


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解
 肼(N2H4)又稱聯氨,是一種可燃性的液體,可用作火箭燃料.
肼(N2H4)又稱聯氨,是一種可燃性的液體,可用作火箭燃料.查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 (2011?丹東模擬)肼(N2H4)又稱聯氨,是一種可燃性液體,其燃燒熱較大且燃燒產物對環境無污染,故可以用作火箭燃料.
(2011?丹東模擬)肼(N2H4)又稱聯氨,是一種可燃性液體,其燃燒熱較大且燃燒產物對環境無污染,故可以用作火箭燃料. N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H+6+OH-
N2H+6+OH- N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H+6+OH-
N2H+6+OH-查看答案和解析>>
科目:高中化學 來源:2013屆遼寧省瓦房店市高二上學期期末考試化學試卷 題型:填空題
(15分)肼(N2H4)又稱聯氨,是一種可燃性的液體,可用作火箭燃料。
(1)已知在25℃,101kPa時,16.0g N2H4在氧氣中完全燃燒生成氮氣,放出熱量312kJ,N2H4完全燃燒反應的熱化學方程式是 。
肼—空氣燃料電池是一種堿性燃料電池,電解質溶液是20%~30%的KOH溶液。肼—空氣燃料電池放電時,負極的電極反應式是: 。電池工作一段時間后,電解質溶液的pH將 (填“增大”、“減小”、“不變”)。
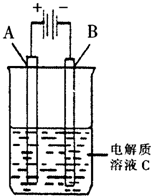
(2)右圖是一個電化學裝置示意圖。用肼——空氣燃料電池做此裝置的電源。如果A是鉑電極,B是石墨電極,C是500mL足量的飽和氯化鈉溶液,當兩極共產生1.12L氣體時,溶液的pH為 ,
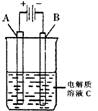
則肼-空氣燃料電池理論上消耗的空氣 L(氣體體積在標準狀況下測定,假設空氣中氧氣體積分數為20%)
(3)肼易溶于水,它是與氨類似的弱堿,用電離方程式表示肼的水溶液顯堿性的原因 。
(4)常溫下將0.2mol/L HCl溶液與0.2mol/L N2H4·H2O溶液等體積混合(忽略混合后溶液體積的變化),若測得混合溶液的pH=6,則混合溶液中由水電離出的c(H+) 0.1
mol/L HCl溶液中由水電離出的c(H+)(填“大于”、“小于”、或“等于”)。
(5)已知:在相同條件下N2H4·H2O的電離程度大于N2H5C1的水解程度。常溫下,若將0.2
mol/L N2H4·H2O溶液與0.1mol/L HCl溶液等體積混合,則溶液中N2H+5、Cl-、OH-、H+
離子濃度由大到小的順序為 。
查看答案和解析>>
科目:高中化學 來源:2010年遼寧省丹東市四校協作體高三上學期第一次聯合考試(理綜)化學 題型:填空題
(15分)
肼(N2H4)又稱聯氨,是一種可燃性液體,其燃燒熱較大且燃燒產物對環境無污染,故可以用作火箭燃料。
(1)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/tool
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=一1135.7kJ/mol
則肼完全燃燒的熱化學方程式為 。
(2)肼——空氣燃料電池是一種堿性燃料電池,電解質溶液是20%—30%的KOH溶液。該電池放電時,正極的電極反應式是 ,電池工作一段時間后,電解質溶液的pH將 (填“增大”、“減小”、“不變”)。
(3)右圖是一個電化學裝置示意圖。用肼——空氣燃料電池做此裝置的電源。
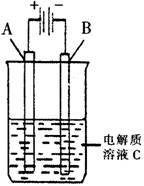
①如果A為含有鋅、銀、金三種雜質的粗銅,B為純銅,C為CuSO4。該裝置的實際意義是 。
②如果A是鉑電極,B是石墨電極,C是AgNO3溶液,若B極增重10.8g,該燃料電池理論上消耗 molN2H4。
(4)肼易溶于水,它是與氨類似的弱堿,用電離方程式表示肼的水溶液顯堿性的原因 。
(5)常溫下將0.2mol/L HCl溶液與0.2mol/L N2H4·H2O溶液等體積混合(忽略混合后溶液體積的變化),若測得混合溶液的pH=6,則混合溶液中由水電離出的c(H+) 0.1mol/LHCl溶液中由水電離出的c(H+)(填“大于”、“小于”、或“等于”)。
(6)已知:在相同條件下N2H4·H2O的電離程度大于N2H5C1的水解程度。常溫下,若將0.2mol/L N2H4·H2O溶液與0.1mol/L HCl溶液等體積混合,則溶液中N2H-5、Cl-、OH-、H+離子濃度南大到小的順序為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com