
 肼(N2H4)又稱聯氨,是一種可燃性的液體,可用作火箭燃料.
肼(N2H4)又稱聯氨,是一種可燃性的液體,可用作火箭燃料.| 16g |
| 32g/mol |
| ||
| 0.56L |
| 22.4L/mol |
| 0.05mol |
| 0.5L |
| 10-14 |
| 0.1 |


科目:高中化學 來源: 題型:
 肼(N2H4)又稱聯氨,是一種可燃性液體,與氧氣或氮氧化物反應均可生成氮氣和水,用作火箭燃料.
肼(N2H4)又稱聯氨,是一種可燃性液體,與氧氣或氮氧化物反應均可生成氮氣和水,用作火箭燃料.查看答案和解析>>
科目:高中化學 來源: 題型:
 肼(N2H4)又稱聯氨,廣泛用于火箭推進劑、有機合成及燃料電池,NO2的二聚體N2O4則是火箭中常用的氧化劑,請回答下列問題:
肼(N2H4)又稱聯氨,廣泛用于火箭推進劑、有機合成及燃料電池,NO2的二聚體N2O4則是火箭中常用的氧化劑,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
 肼(N2H4)又稱聯氨,是一種可燃性液體,用作火箭燃料.
肼(N2H4)又稱聯氨,是一種可燃性液體,用作火箭燃料.查看答案和解析>>
科目:高中化學 來源: 題型:
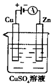 肼(N2H4)又稱聯氨,可用作火箭燃料.肼一空氣燃料電池中的電解質溶液是20%~30%的KOH溶液.該燃料電池可作為如圖裝置中的電源.下列判斷錯誤的是( )
肼(N2H4)又稱聯氨,可用作火箭燃料.肼一空氣燃料電池中的電解質溶液是20%~30%的KOH溶液.該燃料電池可作為如圖裝置中的電源.下列判斷錯誤的是( )查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com