
(Ⅰ)下列操作會導致實驗結果偏高的是 。
A.配制一定物質的量濃度的硫酸溶液時,定容搖勻后,發現液面低于刻度線
B.在配制一定物質的量濃度溶液時,用10 mL的量筒量取5.0 mL液體溶質時俯視讀數
C.用天平稱量20.5 g某物質,砝碼和藥品的位置放反,所得藥品的質量
D.配制一定物質的量濃度的溶液時,定容時俯視讀數,所得溶液的濃度
(Ⅱ)現有下列儀器或用品:
a鐵架臺(含鐵圈、鐵夾);b錐形瓶;c滴定管;d燒杯(若干);e玻璃棒;f膠頭滴管;g托盤天平(含砝碼);h濾紙;i量筒;j漏斗;k溫度計
現有下列試劑:
A.NaOH固體 B.碳酸鈉溶液
C.氯化鎂溶液 D.蒸餾水
試填空:
(1)如圖分別是溫度計、量筒、滴定管的一部分,下述判斷及讀數(虛線刻度)不正確的是 。
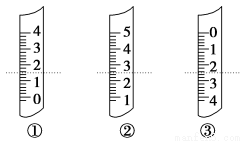
A.①是量筒,讀數為1.5 mL
B.②是量筒,讀數為2.50 mL
C.③是滴定管,讀數為2.50 mL
D.①是溫度計,讀數是1.50 ℃
(2)配制100 mL 0.1 mol·L-1的氫氧化鈉溶液時,還缺少的儀器有 。
(3)除去Mg(OH)2中混有的少量Ca(OH)2,可以用到的試劑是 (選填序號),操作方法是 、 、洗滌。
完成上述操作,上述儀器或用品用到的有 (從上述儀器或用品中選擇,填上相應序號)。
(Ⅰ)D (Ⅱ)(1)ABD (2)藥匙、100 mL容量瓶
(3)CD 溶解 過濾 a、d、e、h、j
【解析】(Ⅰ)液面低于刻度線的原因是容量瓶刻度線上邊的內壁附著液體,對實驗結果無影響;量筒量取5.0 mL液體溶質時俯視讀數,結果偏低;用天平稱量20.5 g某物質,砝碼和藥品的位置放反,所得藥品的質量為19.5 g,結果偏低;配制一定物質的量濃度的溶液時,定容時俯視讀數,所得溶液的濃度偏高。
(Ⅱ)(1)量筒的0刻度在下邊,但沒有標出,滴定管的0刻度在上面,溫度計的0刻度在中間,可知①是溫度計,②是量筒,③是滴定管,再根據只有滴定管精確到0.01 mL,可知C正確。(2)從給出的儀器看,還缺少藥匙和100 mL容量瓶。(3)利用溶解性,Mg(OH)2難溶于水,Ca(OH)2微溶于水,取樣品加入蒸餾水溶解,再加少量氯化鎂溶液,過濾即可除去雜質;用到的儀器或用品:a.鐵架臺(含鐵圈、鐵夾)、d.燒杯(若干)、e.玻璃棒、h.濾紙、i.漏斗。


科目:高中化學 來源:2014年高考化學蘇教版總復習 1-1 物質的分類、轉化及分散系練習卷(解析版) 題型:選擇題
分類方法在化學學科的發展中起到重要的作用。下列分類標準合理的是 ( )
A.根據溶液導電能力強弱,將電解質分為強電解質、弱電解質
B.根據變化過程中是否有化學鍵的斷裂,將物質變化分為物理變化和化學變化
C.根據元素的化合價是否變化,將化學反應分為氧化還原反應和非氧化還原反應
D.根據是否具有丁達爾效應,將分散系分為溶液、濁液和膠體
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版一輪復習2-3-1氧化還原反應概念和規律練習卷(解析版) 題型:選擇題
已知常溫下可用Co2O3制備Cl2,反應前后存在六種微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+。下列敘述不正確的是 ( )。
A.氧化產物為Cl2
B.參加反應的氧化劑與還原劑的物質的量之比為1∶2
C.若有3 mol H2O生成,則反應中有2 mol電子轉移
D.當該反應生成2.24 L Cl2(標準狀況)時,反應中有0.1 mol電子轉移
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版一輪復習2-1物質的分類與轉化 分散系練習卷(解析版) 題型:填空題
取少量Fe2O3粉末(紅棕色)加入適量鹽酸,發生反應的化學方程式: ,
反應后得到的溶液呈 色。用此溶液分別做如下實驗:
(1)取少量溶液置于試管中,滴入幾滴NaOH溶液,可觀察到有紅褐色沉淀生成,反應的化學方程式為 ,此反應屬于 (填反應類型)。
(2)在小燒杯中加入20 mL蒸餾水,加熱至沸騰后,向沸水中滴入幾滴飽和FeCl3溶液,繼續煮沸至溶液呈 色,即制得Fe(OH)3膠體。
(3)取另一只小燒杯也加入20 mL蒸餾水,向燒杯中加入1 mL FeCl3溶液,振蕩均勻后,將此燒杯(編號甲)與盛有Fe(OH)3膠體的燒杯(編號乙)一起放置于暗處,分別用激光筆照射燒杯中的液體,可以看到 燒杯中的液體產生丁達爾效應。這個實驗可以用來區別 。
(4)用Fe(OH)3膠體進行下列實驗:
①將其裝入U形管中,用石墨電極接通直流電,通電一段時間后,發現陰極附近的顏色加深,這說明 ,這種現象稱為 。
②向其中加入飽和(NH4)2SO4溶液發生的現象是 ,原因是 ,
③向其中滴入過量稀硫酸,現象是 ,其原因是 。
④提純此分散系常用的方法是 。
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版一輪復習2-1物質的分類與轉化 分散系練習卷(解析版) 題型:選擇題
下列說法正確的是 ( )。
A.石油裂解、煤的氣化、海水制鎂等過程中都包含化學變化
B.可通過電解熔融MgCl2來制取金屬鎂,故也能通過電解熔融AlCl3來制取鋁
C.鋁熱劑、鹽酸、水玻璃、雙氧水、明礬均為混合物
D.Na2O2、MgCl2、NaOH、NH4Cl均為含共價鍵的離子化合物
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版一輪復習1-2-2溶液的配制及誤差分析練習卷(解析版) 題型:選擇題
實驗中需用2.0 mol·L-1的Na2CO3溶液950 mL,配制時應選用容量瓶的規格和稱取Na2CO3固體的質量分別為 ( )。
A.950 mL;201.4 g B.1 000 mL;212.0 g
C.100 mL;21.2 g D.500 mL;100.7 g
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版一輪復習1-2-1物質的量 氣體摩爾體積練習卷(解析版) 題型:填空題
(1)①48 g RO42-中,核外電子總數比質子總數多6.02×1023個,則R原子的摩爾質量為 。
②有一真空瓶的質量為M1 g,該瓶充入空氣后總質量為M2 g;在相同狀況下,若改充某氣體A后,總質量為M3 g,則A的相對分子質量為 。
(2)一定量的氫氣在氯氣中燃燒,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度為1.12 g·mL-1)恰好完全吸收,測得溶液中含有NaClO的物質的量為0.050 0 mol。
①原NaOH溶液的質量分數為 ;
②所得溶液中Cl-的物質的量為 mol。
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版一輪復習1-1-2物質的分離和提純練習卷(解析版) 題型:選擇題
下列除去雜質的操作中不正確的是 ( )。
A.鐵粉中混有鋁粉:加入過量燒堿溶液充分反應后過濾
B.FeCl2溶液中混有FeCl3:加入過量鐵粉充分反應后過濾
C.Na2CO3固體中混有少量NaHCO3:加入過量NaOH溶液,反應后加熱蒸干
D.氯氣中混有少量氯化氫氣體:將混合氣體通過盛飽和食鹽水的洗氣瓶
查看答案和解析>>
科目:高中化學 來源:2014年高考化學考前題型專練 保溫訓練(一)(解析版) 題型:選擇題
下列說法正確的是 ( )。
A.反應A(g)??2B(g) ΔH,若正反應的活化能為Ea kJ·mol-1,逆反應的活化能為Eb kJ·mol-1,則ΔH=(Ea-Eb)kJ·mol-1
B.標準狀況下,向0.1 mol·L-1的氨水中加入少量氯化銨晶體,若混合溶液pH=7,則c(NH4+)=c(Cl-)
C.足量的鋅銅合金與100 mL pH=1稀硫酸反應,反應3 s時測得pH=2,假設反應前后溶液的體積保持不變,則3 s內產生氫氣的平均速率是33.6 mL·s-1
D.將濃度為0.1 mol·L-1 HF溶液加水不斷稀釋過程中,電離平衡常數Ka(HF)保持不變,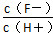 始終保持增大
始終保持增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com