
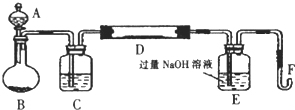
分析 (1)根據裝置圖可知A、B儀器的名稱;
(2)裝置中生成的氧氣含有水蒸氣需要在通入玻璃管前除去水蒸氣,選用濃硫酸進行干燥;鐵礦石和氧氣反應生成氧化鐵和二氧化硫,E裝置是吸收二氧化硫氣防止污染環境;
(3)Ⅱ中加入過量H2O2溶液發生的反應是過氧化氫氧化亞硫酸根離子生成硫酸根離子,過氧化氫被還原為水;
(4)依據配制一定體積溶液的操作步驟分析,需要在250mL容量瓶中配制,滴定終點時溶液會出現淺紅色;
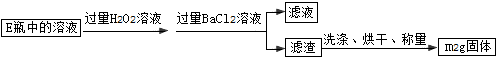
(5)樣品質量為m1g,依據流程分析可知得到硫酸鋇沉淀為m2g,依據硫元素守恒計算硫元素質量得到硫元素的質量分數;
解答 解:(1)根據裝置圖可知A儀器的名稱為分液漏斗,B儀器的名稱為圓底燒瓶,
故答案為:分液漏斗;圓底燒瓶;
(2)裝置中生成的氧氣含有水蒸氣需要在通入玻璃管前除去水蒸氣,選用濃硫酸進行干燥;鐵礦石和氧氣反應生成氧化鐵和二氧化硫,E裝置是吸收二氧化硫氣防止污染環境;
故答案為:濃硫酸;吸收二氧化硫;
(3)Ⅱ中加入過量H2O2溶液發生的反應是過氧化氫氧化亞硫酸根離子生成硫酸根離子,過氧化氫被還原為水,反應的離子方程式為:H2O2+SO32-═SO42-+H2O;
故答案為:H2O2+SO32-═SO42-+H2O;
(4)依據配制一定體積溶液的操作步驟分析,需要在250mL容量瓶中配制,滴定終點的標志是當滴入最后一滴酸性KMnO4標準液時,溶液出現淺紅色,且30S內不復原,
故答案為:250mL容量瓶;當滴入最后一滴酸性KMnO4標準液時,溶液出現淺紅色,且30S內不復原;
(5)樣品質量為m1g,依據流程分析可知得到硫酸鋇沉淀為m2g,硫元素物質的量=硫酸鋇物質的量=$\frac{m{\;}_{2}g}{233g/mol}$=$\frac{m{\;}_{2}}{233}$mol;依據硫元素守恒計算硫元素質量得到硫元素的質量分數=$\frac{\frac{m{\;}_{2}}{233}mol×32g/mol}{m{\;}_{1}g}$×100%=$\frac{32m{\;}_{2}}{233m{\;}_{1}}$×100%,
故答案為:$\frac{32m{\;}_{2}}{233m{\;}_{1}}$×100%.
點評 本題考查了物質性質的實驗探究方法和實驗分析判斷,過程中的定量計算關系是解題關鍵,題目難度中等.


 小學教材完全解讀系列答案
小學教材完全解讀系列答案科目:高中化學 來源:2017屆河南省高三上第一次聯考化學試卷(解析版) 題型:選擇題
四種短周期主族元素W、X、Y、Z的原子序數依次增大,W、X的簡單離子具有相同電子層結構,X 的原子半徑是短周期主族元素原子中最大的,W與Y同族,Z與X形成的離子化合物的水溶液呈中性。下列說法正確的是()
A. 簡單離子半徑:W<X<Z
B. W與X形成的化合物溶于水后溶液呈堿性
C. 氣態氫化物的熱穩定性:W<Y
D. 最高價氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等于15% | B. | 大于15% | C. | 小于15% | D. | 無法估算 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | B. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | ||
| C. | $\frac{{3V}_{2}}{{V}_{1}}$c mol•L-1 | D. | $\frac{3{V}_{1}}{{V}_{2}}$c mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{1}{2}$lg($\frac{b}{a}$) | B. | $\frac{1}{2}$lg($\frac{a}{b}$) | C. | 14+$\frac{1}{2}$lg($\frac{a}{b}$) | D. | 14+$\frac{1}{2}$lg($\frac{b}{a}$) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | A | B | R | D |
| 相關信息 | 基態原子核外電子占據3個能級且最高能級上有3個電子 | B的單質是最常見半導體材料 | 位于第四周期I B族 | 是非金屬元素,其形成的某種單質是電的良導體,有的分子形狀似足球 |
| 鍵能(kJ/mol) | 熔點(K) | 沸點(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
 ,研究表明該離子中每個氯原子最外層均達到8電子穩定結構,有些氯與R之間存在配位鍵,若該長鏈離子中含有n個R,則該離子的化學式為$(CuC{l}_{3}{)_{n}}^{n-}$.
,研究表明該離子中每個氯原子最外層均達到8電子穩定結構,有些氯與R之間存在配位鍵,若該長鏈離子中含有n個R,則該離子的化學式為$(CuC{l}_{3}{)_{n}}^{n-}$. ( AH3配體作為一個整體寫).
( AH3配體作為一個整體寫).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com