
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2015-2016學年山東壽光中學高一上10月月考化學試卷(解析版) 題型:選擇題
金屬鈉與下列物質的溶液反應,既有沉淀生成又有氣體放出的是
A.Mg(NO3)2 B.HNO3 C.Na2SO4 D.NH4Cl
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省長春市高三上學期期中測試化學試卷(解析版) 題型:選擇題
向100mL0.1mol·L-1硫酸亞鐵銨[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。隨著Ba(OH)2溶液體積V的變化,沉淀總物質的量n的變化如下圖所示。則下列說法中正確的是
A.a點時溶液中所含主要溶質為(NH4)2SO4
B.a→b段發生反應的離子方程式是: SO42-+Ba2+===BaSO4↓
C.b點為最大沉淀量,對應的縱坐標值為0.02
D.c點加入Ba(OH)2溶液的體積為200 mL
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省高三上學期第一次模擬化學試卷(解析版) 題型:填空題
(14分)工業上用鋁土礦(主要成分為Al2O3,Fe2O3等)提取Al2O3做冶煉鋁的原料,由熔鹽電解法獲得的粗鋁中含一定量的金屬鈉和氫氣,這些雜質可采用吹氣精煉法除去,產生的尾氣經處理后可用于鋼材鍍鋁。工藝流程如下圖所示:(已知:NaCl熔點為801℃;AlCl3在181℃升華)
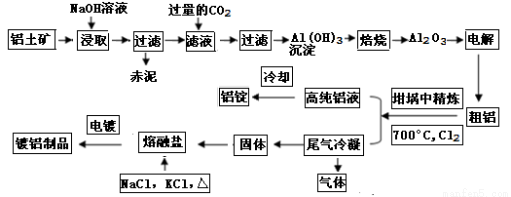
(1)鋼材鍍鋁后,抗腐蝕性能會大大增強,其原因是 。
(2)將Cl2連續通入坩堝中的粗鋁熔體,雜質隨氣泡上浮而除去。氣泡的主要成分除Cl2外還含有 ,固態雜質粘附于氣泡上,在熔體表面形成浮渣,浮渣中肯定存在 。
(3)精煉前,需清除坩堝表面的氧化鐵和石英砂,防止精煉時它們分別與鋁發生置換反應產生新的雜質,則鋁和氧化鐵反應的化學方程式為 。
(4)向濾液中通入過量CO2所發生反應的離子方程式為 。
(5)鍍鋁電解池中,金屬鋁為陽極,熔融鹽電鍍液中鋁元素主要以AlCl4-形式存在,則陽極的電極反應式為_ 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年甘肅蘭州一中高二上期中測試理科化學試卷(解析版) 題型:選擇題
一定條件下,可逆反應C(s)+ CO2(g) 2CO(g)△H>0,達到平衡狀態,現進行如下操作:①升高反應體系的溫度; ②增加反應物C的用量; ③縮小反應體系的體積;④減少體系中CO的量。上述措施中一定能使反應的正反應速率顯著加快的是
2CO(g)△H>0,達到平衡狀態,現進行如下操作:①升高反應體系的溫度; ②增加反應物C的用量; ③縮小反應體系的體積;④減少體系中CO的量。上述措施中一定能使反應的正反應速率顯著加快的是
A、①②③④ B、①③ C、①②③ D、①③④
查看答案和解析>>
科目:高中化學 來源:2016屆福建省高三上學期10月月考化學試卷(解析版) 題型:選擇題
某無色溶液含有下列離子中的若干種:H+、NH4+、Fe3+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-。向該溶液中加入鋁粉,只放出H2,則溶液中能大量存在的離子最多有
A.3種 B.4種 C.5種 D.6種
查看答案和解析>>
科目:高中化學 來源:2014-2015學年山東省濟南外國語學校高三上學期期中測試化學試卷(解析版) 題型:選擇題
某酸溶液的pH=1,此酸溶液的物質的量濃度
A.0.1 mol·L-1
B.一定大于0.1 mol·L-1
C.若為強酸一定等于0.1 mol·L-1,若為弱酸一定大于0.1 mol·L-1
D.若為強酸一定≤0.1 mol·L-1,若為弱酸一定>0.1 mol·L-1
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河南洛陽高級中學高二上9月月考化學試卷(解析版) 題型:實驗題
(共18分)某探究小組用KMnO4酸性溶液與H2C2O4溶液反應過程中溶液紫色消失快慢的方法,研究影響反應速率的因素。實驗條件作如下限定:
所用酸性KMnO4溶液的濃度可選擇0.010 mol·L-1、 0.0010 mol·L-1, 催化劑的用量可選擇0.5 g、0 g,實驗溫度可選擇298 K、323 K。每次實驗KMnO4酸性溶液的用量均為4 mL、H2C2O4溶液(0.10 mol·L-1)的用量均為2 mL。
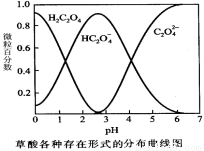
(1)已知草酸溶液中各種微粒存在形式的分布曲線圖如下,請寫出KMnO4酸性溶液與H2C2O4溶液反應的離子方程式 。
(2)請完成以下實驗設計表,并在實驗目的一欄中填出對應的實驗編號:
實驗編號 | T/K | 催化劑的用量 / g | 酸性KMnO4溶液的濃度/mol·L-1 | 實驗目的 |
① | 298 | 0.5 | 0.010 | a.實驗①和②探究酸性KMnO4溶液的濃度對該反應速率的影響; b.實驗①和 探究溫度對反應速率的影響; c.實驗①和 探究催化劑對反應速率的影響。 |
② | ||||
③ | 0.010 | |||
④ |
(3)某同學對實驗①和②分別進行了三次實驗,測得以下實驗數據(從混合振蕩均勻開始計時):
實驗編號 | 溶液褪色所需時間 t / min | ||
第1次 | 第2次 | 第3次 | |
Ⅰ | 14.0 | 13.0 | 11.0 |
Ⅱ | 6.5 | 6.7 | 6.8 |
① 實驗Ⅱ中用KMnO4的濃度變化來表示的平均反應速率為 (忽略混合前后溶液的體積變化)。
②該同學分析上述數據后得出“當其他條件相同的情況下,酸性KMnO4溶液的濃度越小,所需要的時間就越短,亦即其反應速率越快”的結論,你認為是否正確 (填“是”或“否”)。他認為不用經過計算,直接根據表中褪色時間的長短就可以判斷濃度大小與反應速率的關系,你認為是否可行 (填“是”或“否”),若不可行(若認為可行則不填),請設計可以直接通過觀察褪色時間的長短來判斷的改進方案:
(4)該反應的催化劑選擇MnCl2還是MnSO4并簡述選擇的理由:
(5)化學催化劑有很多,在生產和科技領域起到重大作用。探究小組又利用乙裝置探究MnO2對H2O2分解的催化效果。將50 mL H2O2一次性加入盛有0.10 mol MnO2粉末的燒瓶中,測得標準狀況下由量氣管讀出氣體的體積[V(量氣管)/mL]和時間(t/min)的關系如下圖所示。
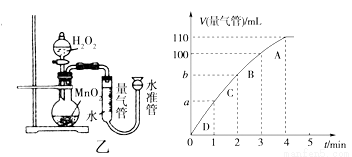
①實驗時放出氣體的總體積是____ ____mL。
②b______ __(填“大于”“小于”或“等于”)90 mL。
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三上學期10月調考理綜化學試卷(解析版) 題型:選擇題
NA為阿伏加德羅常數,下列敘述錯誤的是
A.46 g NO2和N2O4混合氣體中含有原子總數為3NA
B.常溫常壓下,Cu-Zn原電池中,正極產生1.12 L H2時,轉移的電子數應小于0.1NA
C.12 g金剛石中含有的共價鍵數為2NA
D.2.1 g DTO中所含中子數為NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com