
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔點/℃ | 122.4 | -97 | -12.3 |
| 沸點/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
 ,要想提高苯甲酸的轉化率,可以采取的措施是加入過量的甲醇、移去苯甲酸甲酯
,要想提高苯甲酸的轉化率,可以采取的措施是加入過量的甲醇、移去苯甲酸甲酯
分析 (1)根據甲醇易揮發,甲醇的密度小,結合濃硫酸稀釋的方法判斷在燒瓶中混合有機物及濃硫酸的方法,利用碳酸鈉固體洗去苯甲酸甲酯中過量的酸;燒瓶中是苯甲酸與甲醇發生酯化反應生成苯甲酸甲酯,根據影響平衡移動的原理,要想提高苯甲酸的轉化率,可以通過增加另一種反應物濃度或降低生成物濃度的方法;
(2)待燒瓶內的混合物冷卻后,將試管及燒瓶中的液體轉移到分液漏斗中,要使溶液在分液漏斗中充分混合,靜置,再分液,得到的有機物中主要是苯甲酸甲酯,還有溶解在其中的甲醇,據此答題;
(3)根據表中數據,苯甲酸甲酯的沸點是199.6℃進行判斷;
(4)在其他實驗條件相同時,根據反應時間比較有、無濃硫酸存在條件下酯化反應進行的快慢.
解答 解:(1)根據甲醇易揮發,甲醇的密度小,所以在燒瓶中混合有機物及濃硫酸的方法是先將一定量的苯甲酸放入燒瓶中,然后再加入甲醇,最后邊振蕩邊緩慢加入一定量的濃硫酸,利用碳酸鈉固體洗去苯甲酸甲酯中過量的酸,所以試管中盛放的液體可能是Na2CO3溶液,燒瓶中是苯甲酸與甲醇發生酯化反應生成苯甲酸甲酯,反應方程式為 ,根據影響平衡移動的原理,要想提高苯甲酸的轉化率,可以通過加入過量的甲醇、移去苯甲酸甲酯的方法,
,根據影響平衡移動的原理,要想提高苯甲酸的轉化率,可以通過加入過量的甲醇、移去苯甲酸甲酯的方法,
故答案為:先將一定量的苯甲酸放入燒瓶中,然后再加入甲醇,最后邊振蕩邊緩慢加入一定量的濃硫酸;Na2CO3溶液; ;加入過量的甲醇、移去苯甲酸甲酯;
;加入過量的甲醇、移去苯甲酸甲酯;
(2)待燒瓶內的混合物冷卻后,將試管及燒瓶中的液體轉移到分液漏斗中,要使溶液在分液漏斗中振蕩后靜置,再分液,得到的有機產物中主要是苯甲酸甲酯,還有溶解在其中的甲醇,
故答案為:振蕩后靜置;苯甲酸甲酯;甲醇;
(3)苯甲酸甲酯的沸點是199.6℃,用圖C裝置進行蒸餾提純時,當溫度計顯示199.6℃時,可用錐形瓶收集苯甲酸甲酯;
故答案為:199.6;
(4)在其他實驗條件相同時,根據反應時間比較有、無濃硫酸存在條件下酯化反應進行的快慢,即相同時間內兩個試管里生成有機層的厚度或兩個試管中生成相同厚度的有機層所需的時間,
故答案為:相同時間內兩個試管里生成有機層的厚度或兩個試管中生成相同厚度的有機層所需的時間.
點評 本題考查酯的性質,可以類比乙酸乙酯的制取完成,注意酯化反應的原理是酸脫羥基醇脫氫,本題難度中等.


 習題精選系列答案
習題精選系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 離子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 濃度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
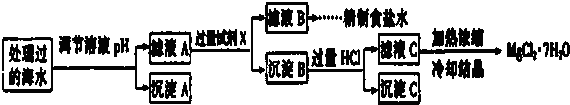
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:
50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 某有機物結構如圖,它不可能具有的性質是( )
某有機物結構如圖,它不可能具有的性質是( )| A. | ①⑤⑦ | B. | ①②③④⑥⑦ | C. | ⑤⑦ | D. | ⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com