
【題目】可逆反應2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0在一定條件下達到平衡狀態,時間為t1時改變條件。化學反應速率與反應時間關系如圖。下列說法中正確的是
2SO3(g) ΔH<0在一定條件下達到平衡狀態,時間為t1時改變條件。化學反應速率與反應時間關系如圖。下列說法中正確的是
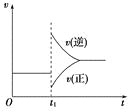
A.維持溫度、反應體系體積不變,t1時充入SO3(g)
B.維持壓強不變,t1時升高反應體系溫度
C.維持溫度不變,t1時擴大反應體系體積
D.維持溫度、壓強不變,t1時充入SO3(g)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下圖是由常見元素組成的一些單質及其化合物之間的轉化關系圖。各方框表示有關的一種反應物或生成物(部分物質已經略去)。其中A、B、D在常溫下均為無色無味的氣體,C是能使濕潤的紅色石蕊試紙變藍的氣體,M是最常見的無色液體。

(1)寫出C→E的化學方程式: 。
(2)實驗室常用加熱兩種固體混合物的方法制備物質C,其化學方程式為: ,干燥C常用 (填寫試劑名稱)。
(3)E物質遇到D物質時,會觀察到 現象,若用排水法收集F,則最終集氣瓶中收集到的氣體為 (填寫物質的化學式)。
(4)寫出A→D的化學方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列熱化學方程式或離子方程式中,正確的是
A. 0.01mol·L﹣1NH4Al(SO4)2溶液與0.02mol·L﹣1Ba(OH)2溶液等體積混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3·H2O
B. 一定條件下,將0.5mol N2(g)和1.5molH2(g)置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C. H2(g)+![]() O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,則H2的燃燒熱為285.8 kJ·mol﹣1
O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,則H2的燃燒熱為285.8 kJ·mol﹣1
D. CO(g)的燃燒熱是283.0 kJ·mol﹣1,則CO2分解的熱化學方程式為:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ·mol﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知甲、乙、丙、X是4種中學化學中常見的物質,其轉化關系符合下圖。則甲和X(要求甲和X能互換)不可能是
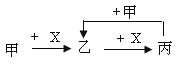
A.C和O2B.SO2 和NaOH溶液
C.Cl2和FeD.AlCl3溶液和NaOH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,相同pH的鹽酸和醋酸分別加水稀釋至平衡,pH隨溶液體積變化的曲線如下圖所 示。據圖判斷正確的是
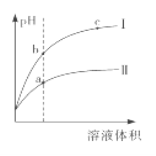
A. Ⅱ為鹽酸稀釋時的pH變化曲線
B. b點溶液的導電性比c點溶液的導電性強
C. a點KW的數值比c點KW的數值大
D. b點酸的總濃度大于a點酸的總濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】閱讀下面的信息,推斷元素及有關物質,按要求回答問題:
信息①:X、Y、Z、W是常見的短周期元素,其原子序數依次增大,且原子核外最外層電子數均不少于2。(1)根據信息①,X一定不是_________(填序號)。
A.氫 B. 碳 C. 氧 D. 硫
信息②:上述四種元素的單質均能在足量的氧氣中燃燒,生成的四種氧化物中,有兩種能溶于稀硫酸,三種能溶于濃氫氧化鈉溶液,氧化物的相對分子質量都大于26。
(2)這四種元素中是否可能有一種是鋁元素?______。
信息③:向上述四種元素單質組成的混合物中加入足量鹽酸溶液,固體部分溶解,過濾,向濾液中加入過量的燒堿溶液,最終溶液中析出白色沉淀。
(3)白色沉淀物的化學式為___________。
信息④:向上述四種元素單質組成的混合物中加入足量燒堿溶液,固體部分溶解,過濾,向濾液中加入過量的鹽酸溶液,最終溶液中析出白色沉淀。
(4)析出白色沉淀的離子方程式為__________________________。
信息⑤:X與W同主族
(5)X與濃硫酸加熱時反應的化學方程式為___;Y在X的氧化物中能劇烈燃燒,其反應現象為__。
(6)已知H![]() 的燃燒熱為285.8 kJ/mol。現有X的氫化物XH4和H2的混合氣體各0.1mol,與O
的燃燒熱為285.8 kJ/mol。現有X的氫化物XH4和H2的混合氣體各0.1mol,與O![]() 完全燃燒生成H2O(1)時,放出的熱量為117.6kJ。則XH4完全燃燒的熱化學反應方程式為:________。
完全燃燒生成H2O(1)時,放出的熱量為117.6kJ。則XH4完全燃燒的熱化學反應方程式為:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應原理對化學反應的研究具有指導意義。
(1)機動車廢氣排放已成為城市大氣污染的重要來源。
①氣缸中生成NO的反應為:N2(g)+O2(g)![]() 2NO(g)△H>0。汽車啟動后,氣缸內溫度越高,單位時間內NO排放量越大,請分析兩點原因。A_____;B______。
2NO(g)△H>0。汽車啟動后,氣缸內溫度越高,單位時間內NO排放量越大,請分析兩點原因。A_____;B______。
②汽車汽油不完全燃燒時還產生CO,若設想按下列反應除去CO:2CO(g)=2C(s)+O2(g) △H>0,該設想能否實現?____(選填“能”或“不能”),依據是____。
(2)一定條件下,Fe3+和I﹣在水溶液中的反應是2I﹣+2Fe3+![]() I2+2Fe2+,當反應達到平衡后,加入CCl4充分振蕩,且溫度不變,上述平衡向____(選填“正反應”或“逆反應”)方向移動。請設計一種使該反應的化學平衡逆向移動的簡單的實驗方案____。
I2+2Fe2+,當反應達到平衡后,加入CCl4充分振蕩,且溫度不變,上述平衡向____(選填“正反應”或“逆反應”)方向移動。請設計一種使該反應的化學平衡逆向移動的簡單的實驗方案____。
(3)已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-ckJ·mol-1
則下列敘述正確的是______
A.由上述熱化學方程式可知b>c
B.甲烷的燃燒熱為bkJ·mol-1
C.2CH3OH(g)=2CH4(g)+O2(g) ΔH=2(b-a)kJ·mol-1
D.若甲醇和甲烷的物質的量之比為1∶2,其完全燃燒生成CO2和H2O(l)時放出的熱量為QkJ,則該混合物中甲醇的物質的量為![]() mol
mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com