
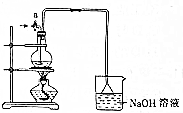
 某化學探究小組為探究能與碳反應的濃硫酸的最低濃度,設計了如圖實驗裝置進行實驗.
某化學探究小組為探究能與碳反應的濃硫酸的最低濃度,設計了如圖實驗裝置進行實驗.分析 有活塞或連接儀器的裝置實驗前必須檢驗裝置氣密性,加熱條件下碳和濃硫酸發生C+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,因二氧化硫、二氧化碳與氫氧化鈉反應,為防止倒吸,吸收裝置利用倒扣漏斗而不是將導管直接插入溶液,裝置中長導氣管兼起導氣冷凝的作用,使水蒸氣冷凝回流,起到了確保硫酸溶液體積保持不變的作用,以此解答該題.
解答 解:(1)實驗裝置是制備二氧化硫氣體的發生裝置,在實驗前需要檢驗裝置氣密性,防止裝置漏氣影響實驗,故答案為:檢驗裝置氣密性;
(2)加熱條件下碳和濃硫酸發生C+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案為:C+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)反應生成二氧化碳、二氧化硫,可與氫氧化鈉溶液反應而被吸收,利用倒置的漏斗而不是將導氣管直接伸入燒杯中是防止液體倒吸,故答案為:CO2、SO2;防倒吸;
(4)由導管a通入足量的空氣,以確保燒瓶中的SO2氣體全部進入燒杯中,裝置中長導氣管兼起導氣冷凝的作用,使水蒸氣冷凝回流,起到了確保硫酸溶液體積保持不變的作用,
故答案為:SO2氣體全部進入燒杯中;冷凝回流;
(5)加入硝酸把亞硫酸鈉氧化為硫酸鈉,加入氯化鋇溶液反應生成硫酸鋇沉淀,通過過濾、洗滌、干燥得到沉淀,稱量固體的質量為27.96g為硫酸鋇沉淀,物質的量=$\frac{27.96g}{233g/mol}$=0.12mol,依據硫元素守恒,被氧化的硫酸為0.12mol,依據化學方程式可知,C+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,反應的硫酸物質的量為0.24mol,剩余硫酸物質的量=18mol/L×0.020L-0.24mol=0.12mol,需要的最低濃度=$\frac{0.12mool}{0.02L}$=6mol/L,
故答案為:過濾、洗滌、干燥;6mol/L.
點評 本題以濃硫酸和Cu的反應為載體考查性質實驗方案設計,為高頻考點,涉及基本計算、基本操作、氧化還原反應等知識點,明確實驗基本操作、物質性質是解本題關鍵,注意實驗的評價,難點是(5)題分析解答.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
| 物理性質 | 制備原理 | 化學性質 |
| 黃色油狀液體,熔點為-40℃,沸點為71℃,不溶于冷水,易溶于有機溶劑,密度為1.65g/mL | Cl2與NH4Cl水溶液在低溫下反應 | 95℃爆炸,熱水中發生水解 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 47.87是豐度最高的鈦原子的相對原子質量 | |
| B. | 鈦原子的M層上共有10個電子 | |
| C. | 從價電子構型看,鈦屬于某主族元素 | |
| D. | 22為鈦原子的質量數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含大量Al3+的溶液中:K+、Na+、NO3-、CO32-不能大量共存,因有Al2(CO3)3沉淀生成 | |
| B. | 含大量Fe3+的溶液中:K+Mg2+、I-、Br2-不能大量共存,因2Fe3++2I-=2Fe2++I2 | |
| C. | 由水電離的c(H+)=1×10-14mol/L的溶液中:Ca2+、NO3-、HCO3-、Cl-不能大量共存,因溶液呈酸性,與HCO3-反應產生CO2氣體 | |
| D. | 在NH4Fe(SO4)2溶液中:Na+、K+、S2-、SCN-不能大量共存,只是因Fe3+和S2-反應產生淡黃色的S沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向MgCl2溶液中加入過量的NaOH溶液,Mg2+沉淀完全,則溶液中不含Mg2+ | |
| B. | Ksp小的物質其溶解能力一定比Ksp大的物質的溶解能力小 | |
| C. | 25℃時,由于Kw(ZnS)>Kw(CuS),所以ZnS在一定條件下可轉化為CuS | |
| D. | 0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 在2L密閉容器內,800℃時反應:2NO(g)+O2(g)?2NO2(g)體系中,n(NO)隨時間的變化如表:
在2L密閉容器內,800℃時反應:2NO(g)+O2(g)?2NO2(g)體系中,n(NO)隨時間的變化如表:| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑦ | B. | ②⑤⑥ | C. | ①④ | D. | ②③⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com