
| 實驗序號 | 溫度T/℃ | A溶液 | B溶液 |
| ① | 30 | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20 | 20mL0.1mol•L-1H2S2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
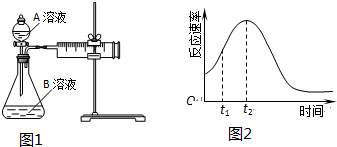
分析 (1)草酸是二元弱酸,在水溶液中不能完全電離,且分步電離;
(2)對比①②實驗可探究濃度對化學反應速率的影響,②中A溶液的濃度比①中大;
(3)先求出反應的(MnO4-)的物質的量,再求出反應后的濃度;
(4)通過測定KMnO4溶液完全褪色所需時間或產生相同體積氣體所需的時間來比較化學反應速率;
(5)催化劑、升高溫度都能加快化學反應的速率.
解答 解:(1)草酸是二元弱酸,在水溶液中不能完全電離,且分步電離以第一步電離為主,電離方程式為:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,
故答案為:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-;
(2)對比①②實驗可探究濃度對化學反應速率的影響,②中A溶液的濃度比①中大,化學反應速率大,所得CO2的體積大,故答案為:濃度;<;
(3)CO2的物質的量是:0.0001mol,設2min末,反應(MnO4-)為X,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
X 0.0001mol
解得:X=0.00002mol
30mL×10-3×0.01mol•L-1-0.00002mol=0.00028mol
c(MnO4-)=$\frac{0.00028}{0.5L}$=0.0056mol/L
故答案為:0.0056;
(4)通過測定KMnO4溶液完全褪色所需時間或產生相同體積氣體所需的時間來比較化學反應速率,故答案為:KMnO4溶液完全褪色所需時間或產生相同體積氣體所需的時間;
(5)催化劑能加快化學反應的速率,產物Mn2+(或MnSO4)是反應的催化劑,此外反應釋放熱量,也可以使化學反應速率加快,故答案為:該反應放熱.
點評 本題考查了影響化學反應速率的因素,難度不大,注意可通過測定KMnO4溶液完全褪色所需時間或產生相同體積氣體所需的時間來比較化學反應速率.


 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案科目:高中化學 來源: 題型:解答題
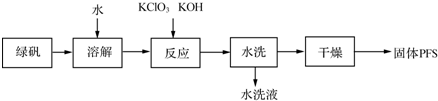
| 方法 | 雙氧水氧化法 | 次氯酸鈉氧化法 | 硝酸氧化法 |
| 原料 | 綠礬、硫酸、雙氧水 | 綠礬、硫酸、次氯酸鈉 | 綠礬、硫酸、濃硝酸等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D、E五種元素是周期表中前四周期的元素.只有A、B、C為金屬且同周期,原子序數A<B<C.A、C核外均沒有未成對電子;B原子核外有二個未成對電子和三個空軌道.D原子最外層電子數是其周期序數的三倍.E能與D形成化合物ED2,可用于自來水的消毒.
A、B、C、D、E五種元素是周期表中前四周期的元素.只有A、B、C為金屬且同周期,原子序數A<B<C.A、C核外均沒有未成對電子;B原子核外有二個未成對電子和三個空軌道.D原子最外層電子數是其周期序數的三倍.E能與D形成化合物ED2,可用于自來水的消毒.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(CH3COO-)+c(OH-)=0.01 mol•L-1 | |
| B. | 與等體積pH=12的氨水混合后所得溶液顯酸性 | |
| C. | 加入少量醋酸鈉固體后所得溶液中c(CH3COO-)減小 | |
| D. | 與等體積0.01 mol•L-1NaNO3溶液混合后有:c(NO3-)=c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/LNaHCO3溶液與0.1mol/LNaOH溶液等體積混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| C. | 0.1mol•L-1的硫化鈉溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 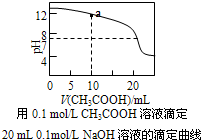 圖中a點溶液中各離子濃度的關系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Al3+、NO3-、SO42- | B. | K+、Na+、CO32-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、Mg2+、I-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所含質子數=A-n | B. | 所含中子數=A-Z | C. | 所含電子數=Z+n | D. | 質量數=Z+A |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
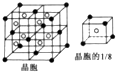 已知A、B、C、D、E、F是周期表中前四周期的六種元素,它們的性質或結構信息如表,請根據信息回答下列問題:
已知A、B、C、D、E、F是周期表中前四周期的六種元素,它們的性質或結構信息如表,請根據信息回答下列問題:| 元素 | 性質或結構信息 |
| A | 單質為黃色粉末,難溶于水,能形成2種二元含氧酸 |
| B | M層有1個未成對的p電子,核外電子總數大于7 |
| C | 與鋰形成的合金常用于航天飛行器,單質能溶于強酸和強堿 |
| D | S電子總數比p電子總數少2個,單質或氧化物均具有很高的熔、沸點 |
| E | 周期表中電負性最大的元素 |
| F | 最外層有2個電子,但次外層有18個電子 |
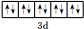 .
.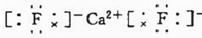 .已知該化合物晶胞$\frac{1}{8}$的體積為2.0×10-23cm3,該離子化合物的密度為3.2g/cm3(保留一位小數).
.已知該化合物晶胞$\frac{1}{8}$的體積為2.0×10-23cm3,該離子化合物的密度為3.2g/cm3(保留一位小數).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com