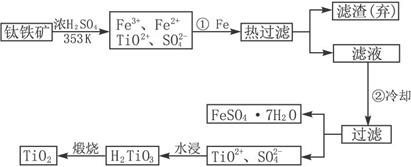
鈦(Ti)被稱為繼鐵、鋁之后的第三金屬,鈍鈦和以鈦為主的合金是新型的結(jié)構(gòu)材料,主要用于航天工業(yè)和航海工業(yè),下列是有關(guān)鈦的冶煉及應(yīng)用的問(wèn)題。
(1)金屬鈦冶煉過(guò)程中其中一步反應(yīng)是將原料金紅石轉(zhuǎn)化:
TiO
2(金紅石)+2C+2Cl
2
TiCl
4+2CO
已知:C(S)+O
2(g)=CO
2(g)

H=-393.5 kJ·mol
-1 2CO(g)+O
2(g)=2CO
2(g)

H=-566 kJ·mol
-1 TiO
2(s)+2Cl
2(g)=TiCl
4(s)+O
2(g)

H=+141 kJ·mol
-1 則TiO
2(g)+2Cl
2(g)+2C(s)=TiCl
4(s)+2CO(g)的

H=______________,
(2)鈉熱還原法是冶煉金屬鈦的方法之一,主要反應(yīng)原理為:4Na+TiCl
4
4NaCl+Ti,該反應(yīng)不能在水溶液中進(jìn)行,一是因?yàn)門iCl
4會(huì)強(qiáng)烈水解生成TiO
2,另一原因_______________(用適當(dāng)化學(xué)方程式輔以必要的文字說(shuō)明)。
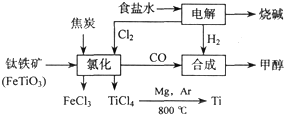
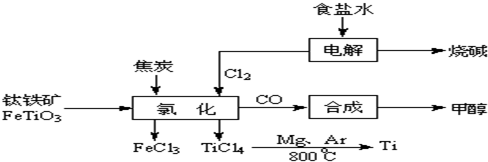
(3)鎂還原法也是冶煉金屬鈦的常用方法,其主要反應(yīng)原理如下:
MgCl
2
Mg+Cl
2 TiCl
4+2Mg

2MgCl
2+Ti
從海水中提取MgCl
2時(shí),先在海水中加入熟石灰,沉淀出Mg(OH)
2,寫出Mg(OH)
2溶度積表達(dá)式:_______________可加入適當(dāng)過(guò)量的熟石灰,從Mg(OH)
2溶解平衡角度解釋其原因_________________
(4)TiCl
4與LiOH在水溶液中一定條件下可反應(yīng)生成Li
4Ti
5O
12(鈦酸鋰),Li
4Ti
5O
12可與LiMn
2O
4(錳酸鋰)等正極材料組成理離子二次電池,工作時(shí)Li
+ 在電池內(nèi)定向移動(dòng),其電池反應(yīng)為:

使用時(shí)先充電,寫出其充電式的陽(yáng)極反應(yīng)_______________,放電時(shí)Li
+的移動(dòng)方向 _______________。

 TiCl4+2CO
TiCl4+2CO  H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1  H=-566 kJ·mol-1
H=-566 kJ·mol-1  H=+141 kJ·mol-1
H=+141 kJ·mol-1  H=______________,
H=______________, 4NaCl+Ti,該反應(yīng)不能在水溶液中進(jìn)行,一是因?yàn)門iCl4會(huì)強(qiáng)烈水解生成TiO2,另一原因_______________(用適當(dāng)化學(xué)方程式輔以必要的文字說(shuō)明)。
4NaCl+Ti,該反應(yīng)不能在水溶液中進(jìn)行,一是因?yàn)門iCl4會(huì)強(qiáng)烈水解生成TiO2,另一原因_______________(用適當(dāng)化學(xué)方程式輔以必要的文字說(shuō)明)。 Mg+Cl2 TiCl4+2Mg
Mg+Cl2 TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti  使用時(shí)先充電,寫出其充電式的陽(yáng)極反應(yīng)_______________,放電時(shí)Li+的移動(dòng)方向 _______________。
使用時(shí)先充電,寫出其充電式的陽(yáng)極反應(yīng)_______________,放電時(shí)Li+的移動(dòng)方向 _______________。 
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2MgCl2(s)+Ti,在Ar氣氛中進(jìn)行的理由是:
2MgCl2(s)+Ti,在Ar氣氛中進(jìn)行的理由是: