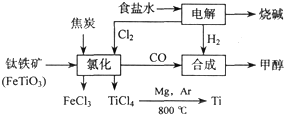
鈦(Ti )被稱為繼鐵、鋁之后的第三金屬.如下圖所示,將鈦廠、氯堿廠和甲醇廠組成產業鏈可以大大提高資源利用率,減少環境污染.請填寫下列空白:
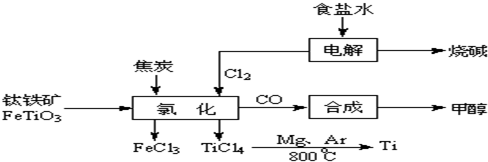
(l)電解飽和食鹽水時,總反應的離子方程式是
2Cl
-+2H
2O

2OH
-+H
2↑+Cl
2↑
2Cl
-+2H
2O

2OH
-+H
2↑+Cl
2↑
.
(2)寫出鈦鐵礦經氯化法得到四氯化鈦的化學方程式(不用寫條件)
2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO
2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO
.
(3)已知:①Mg(s)+Cl
2(g)=MgCl
2(s)△H=-641kJ?mol
-1②Ti(s)+2Cl
2(g)=TiCl
4(s)△H=-770kJ?mol
-1則2Mg(s)+TiCl
4(s)=2MgCl
2(s)+Ti(s)△H=
-512kJ/mol
-512kJ/mol
.
反應2Mg(s)+TiCl
4(s)

2MgCl
2(s)+Ti,在Ar氣氛中進行的理由是:
Mg和Ti都有強還原性,在Ar氣氛中可以防止被氧化.
Mg和Ti都有強還原性,在Ar氣氛中可以防止被氧化.
.
(4)在上述產業鏈中,合成96t 甲醇理論上需額外補充H
25
5
t (不考慮生產過程中物質的任何損失).
(5)以甲醇、空氣、氫氧化鉀溶液為原料,石墨為電極可構成燃料電池.已知該燃料電池的總反應式為:2CH
3OH+3O
2+4OH
-=2CO
32-+6H
2O,正極發生的電極方程式為:3O
2+6H
2O+12e
-=12OH
-.該電池中負極上的電極反應式是
2CH3OH-12e-+16OH-=2CO32-+12H2O
2CH3OH-12e-+16OH-=2CO32-+12H2O
.


 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2MgCl2(s)+Ti,在Ar氣氛中進行的理由是:
2MgCl2(s)+Ti,在Ar氣氛中進行的理由是: 2OH-+H2↑+Cl2↑進行計算;
2OH-+H2↑+Cl2↑進行計算; 2OH-+H2↑+Cl2↑,故答案為:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案為:2Cl-+2H2O  2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑  2MgCl2(s)+Ti(s)在Ar氣氛中進行的理由是Mg和Ti都有較強還原性,在高溫下都易被空氣中的O2氧化.
2MgCl2(s)+Ti(s)在Ar氣氛中進行的理由是Mg和Ti都有較強還原性,在高溫下都易被空氣中的O2氧化. 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑