
| 時間/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.2 | 0.2 | 0.2 |
| 物質(zhì) | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
分析 (1)根據(jù)化學平衡三段式計算,確定反應達到平衡各物質(zhì)的變化量和反應達到化學平衡時各物質(zhì)的濃度;進而計算速率和平衡常數(shù);
(2)若改變某一條件,達新平衡時n(H2)=1.60mol,原平衡狀態(tài)氫氣物質(zhì)的量為2mol,說明氫氣物質(zhì)的量減小,可能是改變條件平衡正向進行,減少氫氣的量;
(3)依據(jù)熱化學方程式和蓋斯定律計算得到人工固氮新方法的熱化學方程式,電解池中失電子的發(fā)生氧化反應;
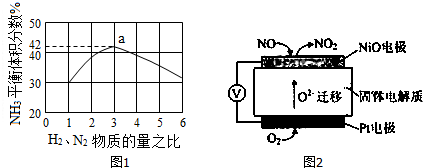
(4)依據(jù)反應特征N2+3H2=2NH3,反應前后氣體體積減小為生成氨氣的體積,相同條件下,氣體體積比等于氣體物質(zhì)的量之比,圖象分析可知平衡狀態(tài)氨氣體積含量42%,設平衡混合氣體體積為 100,氨氣為體積42,計算反應的氮氣,依據(jù)氣體體積比計算原混合氣體中氮氣體積,得到平衡狀態(tài)下氮氣體積分數(shù);
(5)NiO電極上NO失電子和氧離子反應生成二氧化氮;
(6)①2NH3+CO2?NH2COONH4(s),正反應方向混亂度減小,△S<0,根據(jù)△H-T•△S<0反應自發(fā)進行判斷△H;縮小容器的容積可導致容器內(nèi)的壓強增大,平衡正向移動,但條件的改變大于平衡移動的改變;
②2A (g)+B(g)?2C(g)+D(s)反應,反應為氣體體積縮小的反應,容器的體積不變,平衡時壓強增大,故絕熱條件下,混合氣體的溫度升高,即正反應為放熱反應,結(jié)合溫度對平衡移動的影響判斷溫度與平衡常數(shù)的變化關(guān)系;
解答 解:(1)①根據(jù)題意列式計算,從表中分析可知,20min時反應已達平衡,C(NH3)=0.20mol/L
根據(jù)反應 N2 +3H2 $\frac{\underline{\;\;催化劑\;\;}}{高溫高壓}$2NH3
初始濃度(mol/L):0.5 1.3 0
變化濃度(mol/L):0.1 0.3 0.2
平衡濃度(mol/L):0.4 1.0 0.2
5min內(nèi),氨氣生成濃度為0.08mol/L,則氮氣的消耗濃度為0.04mol/L;消耗N2的平均反應速率=$\frac{0.04mol/L}{5min}$=0.008mol/L•min
K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$=$\frac{0.{2}^{2}}{0.4×1.{0}^{3}}$=0.1(L/mol)2
故答案為:0.008mol.L-1.min-1; 0.1;
(2)若改變某一條件,達新平衡時n(H2)=1.60mol,原平衡狀態(tài)氫氣物質(zhì)的量為2mol,說明氫氣物質(zhì)的量減小,可能是改變條件平衡正向進行,減少氫氣的量;
A、平衡不一定正向進行,減小氫氣的量可以符合,故A錯誤;
B、該反應是放熱反應,降低了容器的溫度,平衡向正反應方向進行,氫氣的量減少,故B正確;
C、可能是向容器中加入了一定量的H2氣體,使氫氣量增大,故C錯誤;
D、縮小容器的體積,相當于增大壓強,平衡向氣體體積減小的方向進行,該反應正向是氣體體積減少的反應,所以縮小體積,平衡正向進行,氫氣的量減少,但體積減小帶來的濃度增大比平衡移動帶來氫氣的減少程度大,最終可以是氫氣量增大,故D正確;
故答案為:BD;
(3)①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
②2H2(g)+O2(g)=2H2O(g)△H=-489kJ/mol
依據(jù)蓋斯定律①×2-②×3得到人工固氮新方法的熱化學方程式為:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=1282.2KJ/mol,反應中溶液中氫氧根離子失電子在陽極發(fā)生氧化反應生成氧氣,陽極OH-失去電子發(fā)生氧化反應:4OH--4e-=O2↑+2H2O,
故答案為:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=1282.2KJ/mol,4OH--4e-=O2↑+2H2O;
(4)依據(jù)反應特征N2+3H2=2NH3 △V
1 3 2 2
平衡體積 V V
即反應前后氣體體積減小為生成氨氣的體積,相同條件下,氣體體積比等于氣體物質(zhì)的量之比,圖象分析可知平衡狀態(tài)氨氣體積含量42%,設平衡混合氣體體積為100,氨氣為體積42,則反應前氣體體積100+42=142,氮氣和氫氣按照1:3混合,氮氣體積=142×$\frac{1}{4}$=35.5,依據(jù)化學方程式計算反應的氮氣體積為21,平衡狀態(tài)氮氣為35.5-21=14.5,則氮氣體積分數(shù)為14.5%;
故答案為:14.5%;
(5)NiO電極上NO失電子和氧離子反應生成二氧化氮,所以電極反應式為:NO+O2--2e-=NO2,故答案為:NO+O2--2e-=NO2;
(6)①2NH3+CO2?NH2COONH4(s),正反應方向混亂度減小,△S<0,此反應溫度越低越容易自發(fā)進行,說明在較低溫度下△H-T•△S<0,△H<0,即為放熱反應;縮小容器的容積可導致容器內(nèi)的壓強增大,因此P1<P2,雖然平衡正向移動,但條件的改變大于平衡移動的改變,因此氣體的密度增大,即為ρ1<ρ2,
故答案為:放;<;<;
②由起始D的物質(zhì)的量為0可知,反應2A (g)+B(g)?2C(g)+D(s)向正反應進行建立平衡,正反應是氣體體積減小的反應,容器的體積不變,平衡時壓強增大,故絕熱條件下,混合氣體的溫度升高,則正反應為放熱反應,升高溫度平衡向逆反應進行,化學平衡常數(shù)減小,
故答案為:升高溫度平衡常數(shù)減小.
點評 本題考查了化學平衡影響因素,速率、平衡常數(shù)的計算,平衡狀態(tài)的判斷依據(jù)和方法,蓋斯定律的應用,電解池和原電池原理等知識點,掌握基礎是關(guān)鍵,題目綜合性強,題目難度較大.


科目:高中化學 來源:2016-2017學年江西省高二上第一次月考化學卷(解析版) 題型:選擇題
可逆反應:mA(s)+nB(g) qC(g),在一定溫度的密閉容器中進行,B的體積分數(shù)(V(B)%)與壓強的關(guān)系如圖所示。下列敘述中正確的是( )
qC(g),在一定溫度的密閉容器中進行,B的體積分數(shù)(V(B)%)與壓強的關(guān)系如圖所示。下列敘述中正確的是( )

A.m+n<q B.m+n>q C.n>q D.x點時,v(正)>v(逆)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省高二上10月階段測化學卷(解析版) 題型:選擇題
有NaCl、KSCN、NaOH、AgNO3四種溶液 ,只用一種試劑就把它們鑒別開來,這種試劑是
,只用一種試劑就把它們鑒別開來,這種試劑是
A.鹽酸 B.Na2CO3溶液 C.氯水 D.FeCl3溶液
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化硫的催化氧化是一個放熱反應,升高溫度,正反應速率減小 | |
| B. | 用鐵片和稀硫酸反應制取氫氣時,改用98%的濃硫酸可以增大生成氫氣的速率 | |
| C. | N2(g)+3H2(g)=2NH3(g)達到平衡后,增大c(N2)平衡向右移動,N2的轉(zhuǎn)化率增大 | |
| D. | 汽車尾氣中的NO和CO可以緩慢反應生成N2和CO2,使用催化劑可以增大反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 一定溫度下,在恒容密閉容器中充入2molNO2與1molO2發(fā)生反應如下:
一定溫度下,在恒容密閉容器中充入2molNO2與1molO2發(fā)生反應如下:| 0.01mol•L-1 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由H2、I2、HI組成的平衡體系加壓后顏色變深 | |
| B. | 黃綠色的氯水光照后顏色變淺 | |
| C. | 使用催化劑可加快SO2轉(zhuǎn)化為SO3的速率 | |
| D. | 將木炭粉碎后與O2反應,速率更快 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 充電時陽極反應式為:4Cl-+S+SO2-4e-═2SOCl2 | |
| B. | 電池的電解液可用LiCl水溶液代替 | |
| C. | 放電時電子從負極經(jīng)電解液流向正極 | |
| D. | 該電池放電時,負極發(fā)生還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用乙醚從黃花蒿中提取青蒿素 | |
| B. | 用氯化鐵溶液腐蝕銅制印刷電路板 | |
| C. | 在空氣凈化器中裝入活性炭層 | |
| D. | 服用阿司匹林出現(xiàn)水楊酸反應時用小蘇打解毒 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com