
1.52 g銅鎂合金完全溶解于50 mL密度為1.40 g/mL、質量分數為63%的濃硝酸中,得到NO2和N2O4的混合氣體1120 mL(標準狀況),向反應后的溶液中加入1.0 mol/L NaOH溶液,當金屬離子全部沉淀時,得到2.54 g沉淀。下列說法不正確的是( )
A.該合金中銅與鎂的物質的量之比是2:1
B.該濃硝酸中HNO3的物質的量濃度是14.0 mol/L
C.NO2和N2O4的混合氣體中,NO2的體積分數是80%
D.得到2.54 g沉淀時,加入NaOH溶液的體積是600 mL
D
【解析】分析清楚反應過程,充分利用守恒思想來解決問題。A.向反應后溶液中加入NaOH,生成Mg(OH)2和Cu(OH)2沉淀,固體質量增加的是OH-的質量,且有n(OH-)=n(e-),設合金中鎂、銅的物質的量分別為x、y,
則有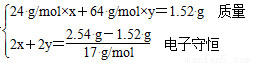
解之得x=0.01mol,y=0.02mol,則該合金中銅、鎂的物質的量之比為2:1。B.該硝酸的濃度c=n/V=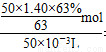 =14.0 mol/L。C. NO2和N2O4都來自硝酸,設混合氣體中NO2的物質的量為x,根據電子守恒得x+(0.05 mol-x)×2=0.06 mol,x=0.04 mol,NO2的體積分數為80%。D.得到2.54 g沉淀后,溶液中的溶質只有NaNO3,故n(NaOH)=0.7 mol-0.04 mol-0.02 mol=0.64 mol,則NaOH溶液的體積是640 mL。
=14.0 mol/L。C. NO2和N2O4都來自硝酸,設混合氣體中NO2的物質的量為x,根據電子守恒得x+(0.05 mol-x)×2=0.06 mol,x=0.04 mol,NO2的體積分數為80%。D.得到2.54 g沉淀后,溶液中的溶質只有NaNO3,故n(NaOH)=0.7 mol-0.04 mol-0.02 mol=0.64 mol,則NaOH溶液的體積是640 mL。
點撥:知識:物質的量濃度的計算、氧化還原反應知識、化學計算。能力:考查考生對所學知識的靈活運用能力,特別是守恒法在化學計算中的靈活運用。試題難度:較大。


科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 離子反應、氧化還原反應練習卷(解析版) 題型:填空題
有一無色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32—、SO42—等離子中的幾種,為分析其成分,取此溶液分別進行四個實驗:
①蘸取溶液進行焰色反應(透過藍色鈷玻璃)顯紫色,
②加入鹽酸酸化的氯化鋇溶液,出現白色沉淀,
③加入過氧化鈉固體,產生無色無味的氣體和白色沉淀,
④取100 mL該溶液逐滴加入過量的5 mol·L-1氫氧化鈉溶液,生成白色沉淀與加入氫氧化鈉的量如圖:

(1)原溶液中一定不存在的離子:____________________________。
(2)為滿足溶液中一定存在的離子要求,一般可溶解兩種常見的物質,其化學式為________、________。
x-y=________mol。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質結構與性質練習卷(解析版) 題型:填空題
Ⅰ.下列有關說法正確的是________。
A.相同類型的離子晶體,晶格能越大,形成的晶體越穩定
B.手性催化劑只催化或者主要催化一種手性分子的合成
C.用金屬的電子氣理論能合理地解釋金屬易腐蝕的原因
D.H3O+、NH4Cl和[Ag(NH3)2]+中均存在配位鍵
Ⅱ.碳及其化合物在自然界中廣泛存在。
(1)基態碳原子的價電子排布圖可表示為________。
(2)第一電離能:碳原子________(填“>”“<”或“=”)氧原子,原因是__________________________。
(3)冰晶胞中水分子的空間排列方式與金剛石晶胞類似。每個冰晶胞平均占有________個水分子,冰晶胞與金剛石晶胞排列方式相同的原因是__________________________。
(4)C60的晶體中,分子為面心立方堆積,已知晶胞中C60分子間的最短距離為d cm,可計算C60晶體的密度為________g/cm3。
(5)請寫出一個反應方程式以表達出反應前碳原子的雜化方式為sp2,反應后變為sp3:________________________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質結構、元素周期律練習卷(解析版) 題型:選擇題
11)有X、Y、Z、W、M五種短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+與M2-具有相同的電子層結構;離子半徑:Z2->W-;Y的內層電子總數是最外層電子數的5倍。下列說法中不正確的是( )
A.W、M的某種單質可作為水處理中的消毒劑
B.電解YW2的熔融物可制得Y和W的單質
C.相同條件下,W的氫化物水溶液酸性比Z弱
D.X、M兩種元素形成的一種化合物與水反應可生成M的某種單質
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質結構、元素周期律練習卷(解析版) 題型:選擇題
X、Y、Z、W均為短周期元素,它們在周期表中的位置如圖所示。已知Y原子的最外層電子數是次外層電子數的3倍,下列說法中正確的是( )

A.原子半徑:W>Z>Y>X
B.最高價氧化物對應水化物的酸性:Z>W>X
C.氫化物的穩定性:X>Y>Z
D.四種元素的單質中,Z單質的熔、沸點最高
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質的量及其應用練習卷(解析版) 題型:選擇題
設NA表示阿伏加德羅常數的數值,下列判斷正確的是( )
A.常溫常壓下,22.4 L CH4中含有的C—H鍵數為4NA
B.4.6 g由NO2和N2O4組成的混合氣體中含有的氧原子數為0.3NA
C.含0. 2 mol H2SO4的濃硫酸與足量Cu反應,生成SO2的分子數為0.1NA
D.1 mol Na在足量O2中燃燒生成Na2O2,鈉失去的電子數為NA
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 物質的組成性質分類及化學用語練習卷(解析版) 題型:選擇題
下列有關物質的性質或應用的敘述正確的是( )
A.MgO的熔點很高,可用于制作耐高溫材料
B.Na2O2是酸性氧化物,因其強氧化性可用于殺菌消毒
C.氨氣是一種堿性氣體,可用P2O5或無水氯化鈣干燥
D.SO2和Cl2都能使品紅溶液褪色,將兩者等體積混合可使它們的漂白能力增強
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 有機化學基礎練習卷(解析版) 題型:選擇題
符合下列條件的烴的一氯代物共有(不考慮立體異構)( )
①分子中碳元素與氫元素的質量之比為21:2;②含一個苯環;③相對分子質量小于150。
A.2種 B.3種 C.4種 D.5種
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習必做訓練 化學能與熱能練習卷(解析版) 題型:選擇題
美國某技術公司開發出納米級催化劑,可在較低溫度下將甲烷轉化成乙烯:2CH4(g)??C2H4(g)+2H2(g) ΔH,已知在降低溫度時該反應平衡向左移動,且有下列兩個反應(Q1、Q2均為正值):
反應Ⅰ:C(s)+2H2(g)=CH4(g) ΔH1=-Q1
反應Ⅱ:C(s)+H2(g)= 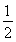 C2H4(g) ΔH2=-Q2
C2H4(g) ΔH2=-Q2
則下列判斷正確的是( )
A.ΔH<0 B.Q2>Q1 C.ΔH=2(Q1-Q2) D.ΔH=Q1-Q2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com