
 化學實驗有助于理解化學知識,形成化學觀念,提高探究與創新能力,提升科學素養.
化學實驗有助于理解化學知識,形成化學觀念,提高探究與創新能力,提升科學素養.分析 (1)①依據原電池原理和鹽橋的作用,在同一燒杯中,電極與溶液含相同的金屬元素,設計不同的電極為銅和鋅,電解質溶液為硫酸銅和硫酸鋅溶液;
②以銅片為電極之一,CuSO4(aq)為電解質溶液,只在一個燒杯中組裝原電池乙,則另一電極應比銅活潑做負極;
③從電硫穩定,能量轉化徹底,反應速率快等分析判斷;
(2)牲陽極的陰極保護法原理是原電池中把被保護的金屬設計成正極,另一活潑的金屬做負極.
解答 解:(1)①在同一燒杯中,電極與溶液含相同的金屬元素,如圖示設計原電池,鋅做負極,銅做正極,原電池的甲裝置示意圖為: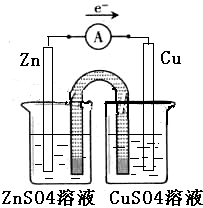 ,故答案為:
,故答案為: ;
;
②以銅片為電極之一,CuSO4(aq)為電解質溶液,只在一個燒杯中組裝原電池乙,依據原電池反應的原理,需要選用比銅活潑的鋅做負極,下層原電池,負極發生氧化反應,Zn-2e-=Zn2+,鋅溶解,故答案為:電極逐漸溶解;
③甲乙兩種原電池中可更有效地將化學能轉化為電能的是甲,因為甲可以保持電流穩定,化學能基本都轉化為電能.而乙中的活潑金屬還可以與CuSO4溶液發生置換反應,部分能量轉化為熱能,
故答案為:甲;甲可以保持電流穩定,化學能基本都轉化為電能.而乙中的活潑金屬還可以與CuSO4溶液發生置換反應,部分能量轉化為熱能;
(2)根據犧牲陽極的陰極保護法原理,是原電池原理的應用,利用被保護的金屬做正極被保護選擇,為減緩電解質溶液中鐵片的腐蝕,應選擇比鐵活潑的金屬做負極,在電池內電路為陽極,稱為犧牲陽極的陰極保護法,材料中 選擇鋅做陽極,
故答案為:鋅片.
點評 本題考查了原電池裝置設計,鹽橋的作用分析應用,金屬保護的方法和名稱,題目難度中等.


 學業測評一課一測系列答案
學業測評一課一測系列答案科目:高中化學 來源: 題型:選擇題
| A. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1,則H2的燃燒熱為-285.8 kJ•mol-1 | |
| B. | 已知:S(g)+O2(g)═SO2(g)△H1=-Q1;S(s)+O2(g)═SO2(g)△H2=-Q2,則Q1<Q2 | |
| C. | 已知:$\frac{1}{2}$H2SO4(濃)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1;CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H2,則有|△H1|<|△H2| | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJ•mol-1 CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 C(石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 則4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1 641.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L溶液中Cl-離子濃度為0.2mol•L-1 | |
| B. | 1L溶液中Cl-離子總數為0.2NA | |
| C. | 1L溶液中Ba2+離子濃度為0.2mol•L-1 | |
| D. | 1L溶液中Ba2+和Cl-離子總數為0.4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知25℃時部分弱電解質的電離平衡常數數據如表所示:
已知25℃時部分弱電解質的電離平衡常數數據如表所示:| 化學式 | CH3COOH | H2CO3 | HClO | |
| 電離平 衡常數 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 放入0.2mol SO2、0.1molO2、0.1mol SO3,達到平衡時SO3必小于amol | |
| B. | 放入0.2mol SO2、0.1molO2、0.2mol SO3,達到平衡時SO3必大于amol | |
| C. | 放入0.4mol SO2、0.1molO2,達到平衡時SO3會等于0.4amol | |
| D. | 放入0.2mol SO2、0.1molO2,達到平衡時SO3必小于amol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將碳塊磨成粉末可以加快反應速率 | |
| B. | 升高溫度一般可以加快反應速率 | |
| C. | 容器體積不變時,向其中充入N2,反應速率不變 | |
| D. | 增加碳的量可以加快反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知熱化學方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,
已知熱化學方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com