
| A. | 濃度均為0.2mol•L-1的NH4Cl溶液與NaOH溶液混合,c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 僅含有Na+、H+、OH-、CH3COO-四種離子的某溶液中可能存c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 常溫下,pH=2的醋酸與pH=12的氫氧化鈉等體積混合后,混合液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 將pH=8.5的氨水加水稀釋后,溶液中所有離子的濃度均降低 |
分析 A.二者恰好完全反應生成NaCl和NH3.H2O,NH3.H2O為弱電解質部分電離,溶液呈堿性,結合物料守恒判斷;
B.如果溶液中溶質為NaOH和CH3COONa且NaOH濃度遠遠大于CH3COONa濃度,則存在c(OH-)>c(CH3COO-);
C.pH=2的醋酸濃度大于NaOH溶液,二者等體積混合后醋酸有剩余,醋酸電離程度大于醋酸根離子水解程度導致溶液呈酸性;
D.pH=8.5的氨水加水稀釋后,促進一水合氨電離,溶液中只有c(H+)增大.
解答 解:A.二者恰好完全反應生成NaCl和NH3.H2O,NH3.H2O為弱電解質部分電離,溶液呈堿性,結合物料守恒得c(Cl-)=c(Na+)>c(NH4+)>c(OH-)>c(H+),故A錯誤;
B.如果溶液中溶質為NaOH和CH3COONa且NaOH濃度遠遠大于CH3COONa濃度,則存在c(OH-)>c(CH3COO-),結合物料守恒得c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故B正確;
C.pH=2的醋酸濃度大于NaOH溶液,二者等體積混合后醋酸有剩余,醋酸電離程度大于醋酸根離子水解程度導致溶液呈酸性則c(OH-)<c(H+),結合電荷守恒得c(Na+)<c(CH3COO-),則溶液中離子濃度大小順序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故C錯誤;
D.pH=8.5的氨水加水稀釋后,促進一水合氨電離,溶液中銨根離子、一水合氨及氫氧根離子濃度都減小,溫度不變水的離子積常數不變,則溶液中c(H+)增大,故D錯誤;
故選B.
點評 本題考查離子濃度大小比較,為高頻考點,側重考查學生分析判斷及知識靈活運用能力,明確溶液中溶質及其性質、溶液酸堿性是解本題關鍵,注意電荷守恒和物料守恒的靈活運用,易錯選項是D.


科目:高中化學 來源: 題型:解答題
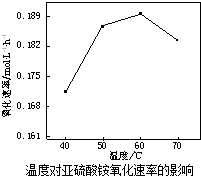 利用氨水吸收煙氣中的二氧化硫,其相關反應的主要熱化學方程式如下:
利用氨水吸收煙氣中的二氧化硫,其相關反應的主要熱化學方程式如下: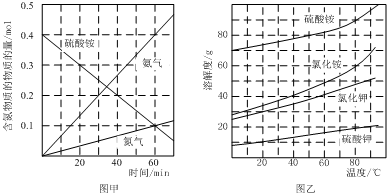
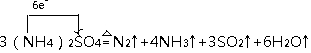 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | abc | B. | bcd | C. | abd | D. | abcd |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鍍鋅鐵片比鍍錫鐵片更耐腐蝕 | |
| B. | 遠洋海輪的尾部裝上一定數量的鋅板 | |
| C. | 用鋅與硫酸制氫氣時,往硫酸中滴少量硫酸銅 | |
| D. | 常溫條件下,在空氣中鋁不易被腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸和醇發生的反應一定是酯化反應 | |
| B. | 由乙烯生成乙醇屬于還原反應 | |
| C. | 在一定條件下,苯與液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反應都屬于取代反應 | |
| D. | 油脂的皂化反應屬于加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3s2表示3s能級有兩個軌道 | |
| B. | 處于最低能量的原子叫做基態原子 | |
| C. | 同一原子中,1s、2s、3s電子的能量逐漸減小 | |
| D. | 同一原子中,3d、4d、5d能級的軌道數依次增多 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
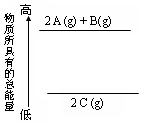
| A. | 2A+B=2C;△H<0 | B. | 2C(g)=2 A(g)+B(g);△H<0 | ||
| C. | 2A(g)+B(g)=2 C(g);△H>0 | D. | 2A(g)+B(g)=2 C(g);△H<0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
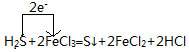 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com