
| A. | 一定溫度下,10mL 0.50mol•L-1NH4Cl溶液與20mL 0.25mol•L-1NH4C1溶液含NH4+物質的量相同 | |
| B. | 25℃時,將a mo1•L-l氨水與0.01 moI•L-1鹽酸等體積混合,反應完全時溶液中c(NH4+)=c(C1-),用含a的代數式表示反應完全時NH3•H2O的電離常數Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定溫度下,已知0.1 mol•L-1 的醋酸溶液中存在電離平衡:CH3COOH?CH3COO-+H+,加少量燒堿溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等體積、pH都為3的酸HA和HB分別與足量的鋅反應,HA放出的氫氣多,說明酸性:HA>HB |
分析 A、NH4Cl 濃度越小,NH4+水解程度越大;
B、當溶液中c(NH4+)=c(C1-),說明溶液呈中性,有c(H+)=c(OH-)=10-7,NH3•H2O的電離平衡常數Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$;
C、要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大,應是平衡向電離的方向移動,結合影響平衡移動的因素解答該題;
D、等體積等PH值的酸,酸的濃度越大,酸性越弱.
解答 解:A、NH4Cl 濃度越小,NH4+水解程度越大,不考慮水解1L 0.50mol•L-1NH4Cl 溶液與2L 0.25mol•L-1 NH4Cl 溶液銨根的物質的量相同,但0.25mol•L-1NH4Cl 溶液中銨根水解程度大,所以含NH4+ 物質的量前者大,故A錯誤;
B、當溶液中c(NH4+)=c(C1-),說明溶液呈中性,有c(H+)=c(OH-)=10-7,故NH3•H2O的電離平衡常數Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.005×1{0}^{-7}}{0.5(a-0.01)}$=$\frac{1{0}^{-9}}{a-0.01}$,故B正確;
C、加入少量燒堿溶液,反應生成CH3COO-,c(H+)減小,由于CH3COO-對CH3COOH的電離起到抑制作用,則$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值減小,故C錯誤;
D、當體積、pH都為3的酸HA和HB分別與足量的鋅反應,HA放出的氫氣多,說明HA的物質的量大于HB的物質的量,溶液的體積相等,HA的物質的量濃度大于HB的,所以說明酸性:HA<HB,故D錯誤;
故選B.
點評 本題考查了鹽類水解程度大小的影響因素、電離平衡常數的計算、弱酸的電離平衡移動、pH相等的酸,酸性越弱其濃度越大,題目難度不大.


 全優點練單元計劃系列答案
全優點練單元計劃系列答案科目:高中化學 來源: 題型:選擇題
 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$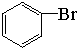 +HBr.
+HBr.| A. | ③④ | B. | ①② | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
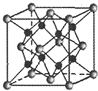 (1)X、Y、Z三種短周期元素,其中X的一種核素是最簡單的原子,Y原子基態時最外層電子數是其內層電子數的2倍,Z原子基態時2p原子軌道上有3個未成對的電子.
(1)X、Y、Z三種短周期元素,其中X的一種核素是最簡單的原子,Y原子基態時最外層電子數是其內層電子數的2倍,Z原子基態時2p原子軌道上有3個未成對的電子.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
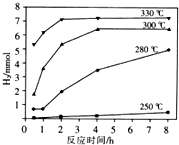 天然氣的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等氣體.
天然氣的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等氣體. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
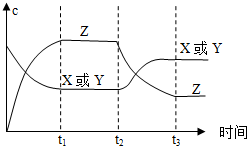 已知X(g)+Y(g)?2Z(g)△H<0.反應發生后,t1時達到平衡,t2時改變條件,t3時達到新平衡,則t2時改變的條件是下列說法中正確的是( )
已知X(g)+Y(g)?2Z(g)△H<0.反應發生后,t1時達到平衡,t2時改變條件,t3時達到新平衡,則t2時改變的條件是下列說法中正確的是( )| A. | 升高溫度 | B. | 減小Z的濃度 | C. | 增大壓強 | D. | 增大X或Y的濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應中的能量變化通常表現為熱量的變化 | |
| B. | 吸熱反應一定需要加熱的條件 | |
| C. | 化學鍵的斷裂和形成是化學反應中能量變化的主要原因 | |
| D. | 反應物和生成物總能量的相對大小決定化學反應放出還是吸收能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、Ba2+、NO3-、Cl- | B. | Na+、NH4+、SO42-、HCO3- | ||
| C. | Ca2+、K+、SO32-、NO3- | D. | Na+、K+、Cu2+、Br- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com