
| A. | 若3molC12反應,得到氧化產物6mol | |
| B. | 若常溫下生成22.4LN2,轉移電子數6NA | |
| C. | 若轉移6mol電子,被氧化的NH3是8mol | |
| D. | 若生成1 molNH4Cl轉移電子n個,則NA=n |
分析 根據反應3C12+8NH3=6NH4Cl+N2可知:此反應中3mol氯氣做氧化劑,被還原為6molNH4Cl,得6mol電子;而8molNH3中有2mol氨氣做還原劑,被氧化為1mol氮氣,此過程中失去6mol電子,即此反應轉移6mol電子,據此分析.
解答 解:根據反應3C12+8NH3=6NH4Cl+N2可知:此反應中3mol氯氣做氧化劑,被還原為6molNH4Cl,得6mol電子;而8molNH3中有2mol氨氣做還原劑,被氧化為1mol氮氣,此過程中失去6mol電子,即此反應轉移6mol電子.
A、氯氣做氧化劑,被還原,故得到的是還原產物,故A錯誤;
B、在常溫下,氣體摩爾體積大于22.4L,故生成的22.4L氮氣的物質的量小于1mol,則轉移的電子書小于6NA個,故B錯誤;
C、當轉移6mol電子時,參與反應的氨氣為8mol,但其中被氧化的是2mol,故C錯誤;
D、此反應生成6mol氯化銨,轉移6mol電子,故當生成1mol氯化銨時轉移1mol電子即NA個,故D正確.
故選D.
點評 本題考查了阿伏伽德羅常數的有關計算,難度不大,應注意公式的運用和物質的結構特點.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在常溫下SiO2(s)+2C(s)=Si(s)+2CO(g)不能自發進行,則該反應的△H>0 | |
| B. | 常溫下,NH4Cl溶液加水稀釋$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$不變 | |
| C. | 向硅酸鈉溶液中滴加酚酞,溶液變紅,證明了Na2SiO3發生了水解 | |
| D. | 如圖可表示乙酸溶液中通入氨氣至過量過程中溶液導電性的變化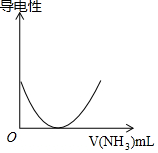 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
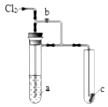 將氯氣通入如圖裝置.若打開活塞,則小試管里的干燥品紅試紙c不褪色;若關閉活塞b,c很快褪色.則a溶液可能是( )
將氯氣通入如圖裝置.若打開活塞,則小試管里的干燥品紅試紙c不褪色;若關閉活塞b,c很快褪色.則a溶液可能是( )| A. | 濃FeCl2溶液 | B. | 飽和KI溶液 | C. | 飽和食鹽水 | D. | 濃NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸堿滴定時,眼睛一定要注視滴定管中液面的變化 | |
| B. | 實驗室制乙烯時,為使受熱均勻,應輕輕攪動溫度計 | |
| C. | 測溶液酸堿性時,須將PH試紙浸入待測液中 | |
| D. | 分液時,下層液體先從分液漏斗下口放出,上層液體后從上口倒出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 醋酸溶液導電性差 | B. | 醋酸溶液中存在醋酸分子 | ||
| C. | 醋酸鈉溶液呈堿性 | D. | 0.1 mol/L醋酸溶液的pH=2.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CaO+H2O→Ca(OH)2 | B. | 2Na+2H2O→2NaOH+H2↑ | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2H2+O2$\stackrel{點燃}{→}$2H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com