
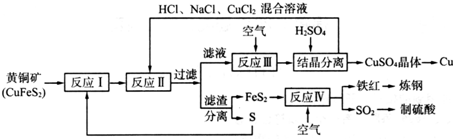
分析 (1)富銅礦砂與空氣在高溫下煅燒,使其轉變為銅,反應產物有污染性氣體二氧化硫生成;
(2)由流程可知,黃鐵礦分解生成的Fe、Cu均為+2價;
(3)反應Ⅲ中生成銅離子;
(4)考慮產物的溶解度,溶解度小的先從溶液中析出;
(5)分析化合價變化,根據化合價的變化來判斷和計算;
(6)①發生氧化還原反應生成硫酸亞鐵;
②利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,可知,3SO2~Cr2O72-,以此計算.
解答 解:(1)富銅礦砂與空氣在高溫下煅燒,要消耗大量的熱能,生成SO2會導致大氣污染,故答案為:SO2會導致大氣污染,同時要消耗大量的熱能;
(2)由流程可知,黃鐵礦分解生成的Fe、Cu均為+2價,則反應I的產物為FeS2、CuS,故答案為:FeS2、CuS;
(3)反應Ⅲ中生成銅離子,則離子反應為4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O,故答案為:4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O;
(4)相同條件下硫酸銅的溶解度小,則該溫度下,硫酸銅的溶解度小于氯化銅,所以向反應Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸銅晶體,
故答案為:該溫度下,硫酸銅的溶解度小于氯化銅;
(5)A.反應中被還原的除了O元素還有Cu元素,故A錯誤;B.二氧化硫為大氣污染物,故B正確;C.從S元素化合價變化看,二氧化硫為氧化產物,從O元素化合價變化看,二氧化硫為還原產物,故C正確;D.8CuFeS2反應轉移電子為8×2+21×4=100,故D正確,故選B、C、D;
(6)①發生氧化還原反應生成硫酸亞鐵,離子反應為SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,故答案為:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②利用14H++Cr2O72-+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,
可知,3SO2~Cr2O72-,
3 1
x 0.02mol/L×0.025L
解得x=0.0015mol,
反應Ⅳ所得氣體中SO2的體積分數為:$\frac{0.0015mol}{0.28L/22.4L/mol}$×100%=12.00%,
故答案為:12.00%.
點評 本題以實際化工生產“黃銅礦的綜合利用”為背景,考查了元素化合物知識,離子方程式和化學方程式的書寫及有關計算,題目更注重考查學生利用化學原理來解決實際問題的能力,利用關系式計算可簡化計算.


科目:高中化學 來源: 題型:解答題

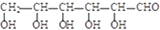 堿性條件下氧化為
堿性條件下氧化為 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 推廣“低碳經濟”,減少溫室氣體的排放 | |
| B. | 開發太陽能、風能和氫能等能源代替化石燃料,有利于節約資源、保護環境 | |
| C. | 采用“綠色化學”工藝,使原料盡可能轉化為所需要的物質 | |
| D. | 關停化工企業,消除污染源頭 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
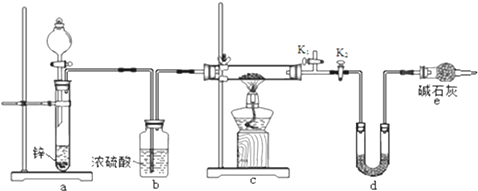
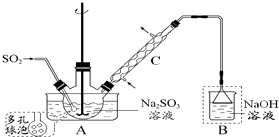 次硫酸氫鈉甲醛(NaHSO2•HCHO•2H2O) 俗稱吊塊,在印染、醫藥以及原子能工業中應用廣泛.實驗室以Na2SO3、SO2、HCHO和鋅粉為原料,通過以下反應制得:
次硫酸氫鈉甲醛(NaHSO2•HCHO•2H2O) 俗稱吊塊,在印染、醫藥以及原子能工業中應用廣泛.實驗室以Na2SO3、SO2、HCHO和鋅粉為原料,通過以下反應制得:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
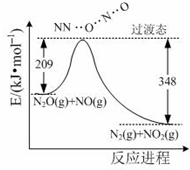 氨是合成硝酸、銨鹽和氮肥的基本原料,回答下列問題:
氨是合成硝酸、銨鹽和氮肥的基本原料,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
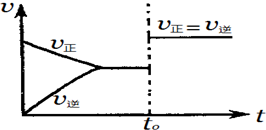
| A. | 若a+b=c,則t0時可能是增大反應體系的壓強 | |
| B. | 若a+b=c,則t0時不可能是加入催化劑 | |
| C. | 若a+b≠c,則t0時只可能是加入催化劑 | |
| D. | 若a+b≠c,則t0時有可能是增大反應體系的壓強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH均為12的燒堿溶液與Ba(OH)2溶液的物質的量濃度之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)與c(SO42-)之比 | |
| C. | 0.2mol/L的CH3COOH溶液與0.1mol/L和CH3COOH溶液中c(H+)之比 | |
| D. | 0.2mol/L的HCl與0.1mol/LHNO3溶液中n(H+)之比 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 此白色固體不可能是KHCO3和KOH的混合物 | |
| B. | 此白色固體中含有K2CO36.90g | |
| C. | 原KOH溶液的物質的量濃度是0.500 mol•L-1 | |
| D. | 此白色固體可能為KOH和K2CO3的混合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | PCl3的水解產物是PH3和HCl | B. | CuCl2的水解產物是Cu(OH)2和HCl | ||
| C. | NaClO的水解產物是HClO和NaOH | D. | CaO2的水解產物是Ca(OH)2和H2O2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com