
【題目】氫氧燃料電池是符合綠色化學理念的新型發電裝置,如圖為電池示意圖,該電池電極表面鍍層鉑粉(鉑粉吸附氣體的能力強,性質穩定),請回答下列問題:
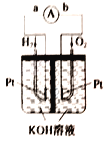
(1)該裝置能量轉化的主要形式是_________。
(2)在導線中電子流動方向為_________(用a、b表示)。
(3)負極反應式為_________ 。
(4)電極表面鍍鉑粉的目的:_________。
(5)若將該電池中的KOH溶液換為稀硫酸,內電路溶液中H+向_________ (填“正極”或“負極”)移動,電池工作時正極的反應式為_________。
【答案】 由化學能轉變為電能 由a到b H2+2OH--2e-=2H2O 增大電極單位面積吸附H2、O2分子數,加快電極反應速率 正極 O2+4H++4e-=2H2O
【解析】(1)原電池的實質為化學能轉化成電能,(2)氫氧燃料電池總反應為2H2+O2=2H2O,其中H元素的化合價從零價升至+1價,失去電子,即電子從a流向b;(3)負極為失去電子的一極,即H2失電子生成H+,由于溶液是堿性的,負極反應式為 H2+2OH--2e-=2H2O;(4)電極表面鍍鉑粉的目的:增大電極單位面積吸附H2、O2分子數,加快電極反應速率;(5)若將該電池中的KOH溶液換為稀硫酸,內電路溶液中H+向正極;電池工作時正極的反應式為O2+4H++4e-=2H2O。


 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:
【題目】(1)紅磷P(s)和Cl2(g)發生反應生成PCl3(g)和PCl5(g),反應過程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
氣態PCl5生成氣態PCl3和Cl2的熱化學方程式為________.
(2)不同溫度下反應CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1的平衡常數如下表所示。
CO2(g)+H2(g) ΔH1的平衡常數如下表所示。
溫度/℃ | 400 | 500 | 800 |
平衡常數K | 9.94 | 9 | 1 |
則ΔH1______0(填“<”“>”);在500℃時,把等物質的量濃度的CO和H2O(g)充入反應容器,達到平衡時c(CO)=0.005mol/L、c(H2)=0.015mol/L,則CO的平衡轉化率為______。
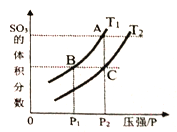
(3)在一定體積的絕熱密閉容器中,對于反應2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判斷該反應達到平衡狀態的標志是_____________。
2SO3(g) ΔH<0,判斷該反應達到平衡狀態的標志是_____________。
A.SO2和SO3濃度相等
B.容器中混合氣體的密度保持不變
C.容器中氣體的溫度保持不變
D.SO3的生成速率與SO2的消耗速率相等
當溫度為T1、T2時,平衡體系SO3的體積分數隨壓強變化曲線如上圖所示。則T1____T2 (填“>”或“<");理由是_____。如果想加快正反應的速率,除了改變溫度,還可以用_______方法。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室里用硫酸廠燒渣(主要成分為鐵的氧化物及少量FeS、SiO2等)制備聚鐵(堿式硫酸鐵的聚合物)和綠礬(FeSO4·7H2O),其過程如下:
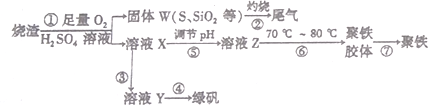
(1)過程③中,需要加入的物質名稱是____________________。
(2)過程②中產生的尾氣會對大氣造成污染,可選用下列試劑中的___________吸收。
a.濃硫酸 b.蒸餾水 c.NaOH溶液 d.濃硝酸
(3)過程①中,FeS和O2、H2SO4反應的化學方程式為____________________。
(4)過程④的實驗操作是____________________。
(5)過程⑥中,將溶液Z加熱到70℃~80℃,目的是 ___________________。
(6)某種脫硫脫硝工藝中將廢氣經處理后,與一定量的氨氣、空氣反應,生成硫酸銨和硝酸銨的混合物作為副產品化肥。設廢氣中的SO2、NO2的物質的量之比為1:1,則該反應的化學方程式為__________________。
(7)實驗室為測定所得到的聚鐵樣品中鐵元素的質量分數,進行下列實驗。①用分析天平稱取樣品2.700 g;②將樣品溶于足量鹽酸后,加入足量的氯化鋇溶液:③過濾、洗滌、干燥、稱量,得固體質量為3.495g,若該聚鐵主要成分為[Fe(OH)SO4]a,則該聚鐵中鐵元素的質量分數為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解在化工生產、金屬冶煉及科學研究等方面有重要應用。
(1)工業上用電解熔融氧化鋁的方法來制取金屬鋁。純凈氧化鋁的熔點很高(約2045℃),在實際生產中,通過加入助熔劑冰晶石Na3AlF6) 在1000℃左右就可以得到熔融體。
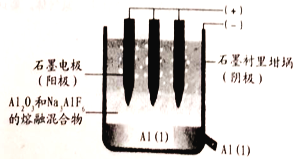
①寫出電解時陽極的電極反應式:___________。
②電解過程中作陽極的石墨易消耗,原因是___________。
(2) 電解食鹽水是氯破工業的基礎。
①電解所用食鹽水由粗鹽水精制而成,精制時,為除去Mg2+和Ca2+,要加入的試劑分別為____、_____。電解時,陰極反應的主要產物是___________。
②電解時用鹽酸控制陽極區的pH在2~3,用必要的文字和反應方程式說明原因: ___________。
(3)Cu2O是半導體材料,工業上常用電解法制取。電解裝置如下圖所示。
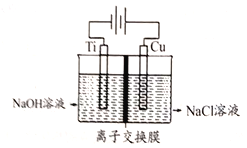
電解裝置中采用離了交換膜控制陽極區OH-的濃度而制備納米Cu2O。該離子交換膜是____(填“陰”或“陽”)離子交換膜,陽極生成Cu2O的電極反應式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某高分子化合物R的結構簡式如右圖,下列有關R的說法正確的是
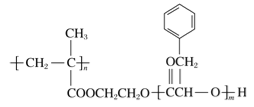
A. R的一種單體的分子式為C9H10O2
B. R完全水解后的生成物均為小分子有機物
C. 可以通過加聚反應和縮聚反應合成R
D. 堿性條件下,1 mol R完全水解消耗NaOH的物質的量為2 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有100mL1mol/L稀鹽酸,欲將其濃度變為2mol/L,可以采取的措施為( )
A. 向其中通入標況下22.4LHCl氣體 B. 加熱蒸發使溶液體積變為50mL
C. 加熱蒸發掉50mL水 D. 加入5mol/L鹽酸100mL,再將溶液體積稀釋到300mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨是最重要的氮肥,是產量最大的化工產品之一。德國人哈伯在1905年發明了合成氨的方法,其合成原理為:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此獲得了1918年諾貝爾化學獎。密閉容器中,使2 mol N2和6 mol H2混合發生反應:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此獲得了1918年諾貝爾化學獎。密閉容器中,使2 mol N2和6 mol H2混合發生反應:N2(g)+3H2(g)![]() 2NH3(g)(正反應為放熱反應)。
2NH3(g)(正反應為放熱反應)。
(1)當反應達到平衡時,N2和H2的濃度比是___________;N2和H2的轉化率比是_____________。
(2)升高平衡體系的溫度(保持體積不變),混合氣體的平均相對分子質量____________,密度_____________。(填“變大”、“變小”或“不變”)
(3)當達到平衡時,充入氬氣,并保持壓強不變,平衡將_____________(填“正向”、“逆向”或“不”)移動。
(4)若容器恒容、絕熱,加熱使容器內溫度迅速升至原來的2倍,平衡將________(填“向左移動”、“向右移動”或“不移動”)。達到新平衡后,容器內溫度________(填“大于”、“小于”或“等于”)原來的2倍。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在四種不同情況下,可逆反應A(g)+2B(g)C(g)+D(g)的反應速率如下,其中反應進行得最快的是
A. v(A)=0.15 mol/(L·min) B. v(B)=0.6 mol/(L·min)
C. v(C)=0.4 mol/(L·min) D. v(D)=0.02 mol/(L·s)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com