
分析 已知Ksp(AgCl)>Ksp(AgI)>ksp(Ag2S),在溶液中,難溶電解質可轉化為溶度積更小的物質,以此解答該題.
解答 解:已知Ksp(AgCl)>Ksp(AgI)>ksp(Ag2S),向盛有10滴0.1mol/L AgNO3溶液的試管中滴加0.1mol/L NaCl溶液,至不再有白色沉淀生成,再向其中滴加0.1mol/L KI溶液,可生成AgI沉淀,白色沉淀轉化為黃色沉淀,然后向其中滴加0.1mol/L Na2S溶液,可生成硫化銀沉淀,黃色沉淀轉化為黑色沉淀,
故答案為:白色沉淀轉化為黃色沉淀;黃色沉淀轉化為黑色沉淀.
點評 本題考查了沉淀的轉化,為高頻考點,側重學生的分析能力的考查,把握溶度積小的沉淀能轉化為溶度積大的沉淀為解答的關鍵,題目比較簡單.


科目:高中化學 來源: 題型:選擇題
| A. | 0.1 | B. | 0.05 | C. | 0.04 | D. | 0.02 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 體積不變充入惰性氣體,反應速率增大 | |
| B. | 其他條件不變,降低溫度,平衡轉化率一定變化 | |
| C. | 其他條件不變時,增大壓強,平衡左移,平衡常數K減小 | |
| D. | 若增加或減少A物質的量,反應速率一定會發生明顯的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ksp只與難溶電解質的性質和溫度有關 | |
| B. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定條件下可轉化為CuS沉淀 | |
| C. | 難溶電解質Mg(OH)2的Ksp=c( Mg2+)•c(OH-) | |
| D. | 25℃,Ksp(AgCl)=1.8×10-10,則AgCl飽和水溶液體系中c(Ag+)為$\sqrt{1.8}$×10-5mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 容器 | 甲 | 乙 |
| 反應物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡時c(CH3OH) | c1 | c2 |
| 平衡時能量變化 | 放出29.4kJ | 吸收 a kJ |
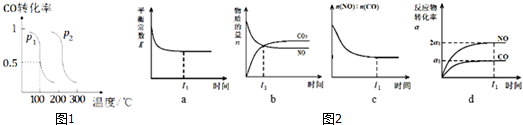
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
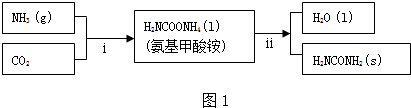

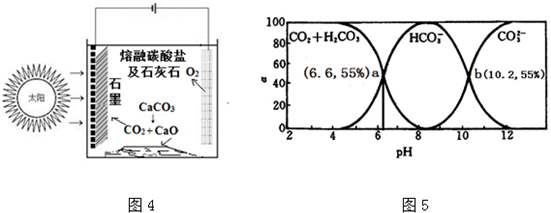
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com