
分析 (1)根據A的質量和A的物質的量計算出A的摩爾質量,根據氯原子質量守恒,1.20molCl2完全反應,生成0.800molAClx,可以計算出x;
(2)實際上配制的是100mL溶液,根據n=cV計算出氯化鈉的物質的量,然后根據m=nM計算出需要氯化鈉的質量;
(3)①根據n=$\frac{m}{M}$計算物質的量;,發生Fe+2HCl=FeCl2+H2↑,列出鐵與鹽酸物質的量的關系式,結合c=$\frac{n}{V}$以此計算;
②發生Fe+2HCl=FeCl2+H2↑,列出鐵與氫氣物質的量的關系式以此計算.
解答 解:(1)根據質量守恒,0.800molAClx中含有0.800molA和0.800xmolCl,
所以1.20molCl2中含有2.4molCl,即0.800xmol=2.4,解得:x=3,
21.6gA的物質的量為0.800mol,A的摩爾質量為:$\frac{21.6g}{0.800mol}$=27g/mol,
故答案為;3;27g/mol.
(2)實驗室需要2.0mol•L-1NaOH溶液90mL,實際上配制的是100mL 2.0mol/LNaOH溶液,需要氫氧化鈉的物質的量為:2.0mol/L×0.1L=0.2mol,需要氫氧化鈉的質量為:40g/mol×0.2mol=8.0g,
故答案為:8.0;
(3)①n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,設鹽酸的物質的量為xmol,由反應Fe+2HCl=FeCl2+H2↑可知,
Fe+2HCl=FeCl2+H2↑
1 2
0.1mol xmol
則$\frac{1}{0.1mol}$=$\frac{2}{xmol}$,解得:x=0.2,
則該鹽酸的濃度為:c(HCl)=$\frac{0.2mol}{0.1L}$=2.0mol/L,
答:所用鹽酸中HCl的物質的量濃度為2.0mol/L;
②設生成氫氣的物質的量為ymol,根據反應可知:
Fe+2HCl=FeCl2 +H2↑
1 1
0.1mol ymol
則有:$\frac{1}{0.1mol}$=$\frac{1}{ymol}$,解得:y=0.1,
即n(H2)=0.1mol,標況下體積生成氫氣的體積為:V=0.1mol×22.4L/mol=2.24L,
答:生成的H2在標準狀況下的體積為2.24L.
點評 本題考查了物質的量的計算,題目難度中等,明確物質的量與摩爾質量、氣體摩爾體積、物質的量濃度之間的關系即可解答,試題培養了學生的分析能力及化學計算能力.


 浙大優學小學年級銜接捷徑浙江大學出版社系列答案
浙大優學小學年級銜接捷徑浙江大學出版社系列答案科目:高中化學 來源: 題型:選擇題
| 時間/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s內用O2表示的平均速率為1.48×10-3 mol/(L•s) | |
| B. | T1溫度下的平衡常數為K1,T2溫度下的平衡常數為K2,若T1>T2,則K1<K2 | |
| C. | T1溫度下N2O5的平衡轉化率為50% | |
| D. | 平衡后其它條件不變,將容器的體積壓縮到原來的一半,則再平衡時c(N2O5)>5.00mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵粉與稀硫酸反應:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用小蘇打 (NaHCO3)治療胃酸過多:HCO3-+H+═H2O+CO2↑ | |
| C. | 往碳酸鎂中滴加稀鹽酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 氫氧化鋇溶液與稀H2SO4反應:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
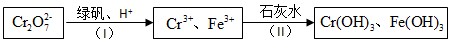
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入稀鹽酸能產生無色氣體,則一定有CO32- | |
| B. | 加入氯化鋇溶液有白色沉淀產生,再加鹽酸,沉淀不消失,則一定有Ag+ | |
| C. | 加入氫氧化鈉溶液并加熱,產生的氣體能使濕潤紅色石蕊試紙變藍,則一定有NH4+ | |
| D. | 加入碳酸鈉溶液產生白色沉淀,再加鹽酸,白色沉淀消失,則一定有Ca2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題


 )的廢水可以通過構成微生物電池除去,其原理如圖5所示.
)的廢水可以通過構成微生物電池除去,其原理如圖5所示.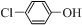 +2e-+H+═
+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com