
【題目】氮及其化合物在工農業生產中具有重要作用.
(1)某小組進行工業合成氨![]() 的模擬研究,在1L密閉容器中,分別加入0.1molN2和0.3molH2,實驗
的模擬研究,在1L密閉容器中,分別加入0.1molN2和0.3molH2,實驗![]() 、
、![]() 、
、![]() 中
中![]() 隨時間
隨時間![]() 的變化如圖所示.
的變化如圖所示.
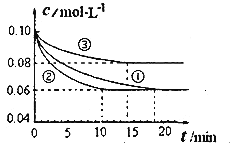
實驗![]() 從開始到達到平衡狀態的過程中,用
從開始到達到平衡狀態的過程中,用![]() 表示的平均反應速率為 ___________.與實驗
表示的平均反應速率為 ___________.與實驗![]() 相比.實驗
相比.實驗![]() 所采用的實驗條件可能為 ___________
所采用的實驗條件可能為 ___________![]() 填字母
填字母![]() ,實驗
,實驗![]() 所采用的實驗條件可能為 ___________
所采用的實驗條件可能為 ___________![]() 填字母
填字母![]() .
.
![]() 增大壓強
增大壓強 ![]() 減小壓強
減小壓強 ![]() 升高溫度
升高溫度 ![]() 降低溫度
降低溫度 ![]() 使用催化劑
使用催化劑
(2)![]() 可用于處理廢氣中的氮氧化物,其反應原理為2NH3(g)+ NO(g)+ NO2(g)
可用于處理廢氣中的氮氧化物,其反應原理為2NH3(g)+ NO(g)+ NO2(g)![]() 2N2(g)+ 3H2O(g) △H<0,欲提高廢氣中氮氧化物的轉化率,可采取的措施是 ___________
2N2(g)+ 3H2O(g) △H<0,欲提高廢氣中氮氧化物的轉化率,可采取的措施是 ___________![]() 填字母
填字母![]()
![]() 升高溫度
升高溫度 ![]() 增大壓強 c,增大
增大壓強 c,增大![]() 的濃度
的濃度
(3)![]() 遇水發生水解反應,生成
遇水發生水解反應,生成![]() 的同時得到 ___________
的同時得到 ___________![]() 填化學式
填化學式![]() 是廣譜高效消毒劑,制備原理為
是廣譜高效消毒劑,制備原理為![]() 若轉移1mol電子,則制取
若轉移1mol電子,則制取![]() 的質量為 ___________.
的質量為 ___________.
(4)![]() 時,將
時,將![]() 的氨水與
的氨水與![]() 鹽酸等體積混合,反應后溶液恰好顯中性,則a ___________
鹽酸等體積混合,反應后溶液恰好顯中性,則a ___________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 用a、b表示
用a、b表示![]() 的電離平衡常數為 ___________.
的電離平衡常數為 ___________.
【答案】0.012mol/(L·min) ![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
![]() 由圖可知,實驗
由圖可知,實驗![]() 到達平衡,平衡時△c(N2)=0.1mol/L-0.06mol/L=0.04mol/L,再根據方程式計算
到達平衡,平衡時△c(N2)=0.1mol/L-0.06mol/L=0.04mol/L,再根據方程式計算![]() ,根據
,根據![]()
![]() 計算
計算![]() ;
;
由圖可知,與實驗![]() 相比,實驗
相比,實驗![]() 到達平衡所以時間較短,反應速率較快,但平衡時氮氣的濃度不變,改變條件平衡不移動,該反應正反應是氣體體積減小的反應,故實驗
到達平衡所以時間較短,反應速率較快,但平衡時氮氣的濃度不變,改變條件平衡不移動,該反應正反應是氣體體積減小的反應,故實驗![]() 應是使用催化劑;
應是使用催化劑;
由圖可知,與實驗![]() 相比,實驗
相比,實驗![]() 到達平衡所以時間較短,反應速率較快,平衡時氮氣的濃度增大,改變體積平衡向逆反應移動,據此結合選項判斷;
到達平衡所以時間較短,反應速率較快,平衡時氮氣的濃度增大,改變體積平衡向逆反應移動,據此結合選項判斷;
![]() 提高廢氣中氮氧化物的轉化率,應改變條件使平衡向正反應移動,結合平衡移動原理分析;
提高廢氣中氮氧化物的轉化率,應改變條件使平衡向正反應移動,結合平衡移動原理分析;
![]() 遇水發生水解反應,
遇水發生水解反應,![]() 分子中負價原子結合水電離的氫離子,正價原子結合水電離的去氫根離子,據此判斷雙鍵產物; 根據得失電子守恒判斷計算;
分子中負價原子結合水電離的氫離子,正價原子結合水電離的去氫根離子,據此判斷雙鍵產物; 根據得失電子守恒判斷計算;
![]() 溶液顯中性,所以
溶液顯中性,所以![]() ,溶液的電荷守恒可得:
,溶液的電荷守恒可得:![]() ,故
,故![]() ,氯化銨是強酸弱堿鹽其水溶液呈酸性,要使氯化銨溶液呈中性,則氨水應稍微過量;
,氯化銨是強酸弱堿鹽其水溶液呈酸性,要使氯化銨溶液呈中性,則氨水應稍微過量;
電常數只與溫度有關,結合電離常數Kb的表達式計算。
![]() 由圖可知,實驗
由圖可知,實驗![]() 到達平衡,平衡時△c(N2)=0.1mol/L-0.06mol/L=0.04mol/L,由方程式可知,
到達平衡,平衡時△c(N2)=0.1mol/L-0.06mol/L=0.04mol/L,由方程式可知,![]() ,故
,故![]()
![]()
![]() ,
,
由圖可知,與實驗![]() 相比,實驗
相比,實驗![]() 到達平衡所以時間較短,反應速率較快,但平衡時氮氣的濃度不變,改變條件平衡不移動,該反應正反應是氣體體積減小的反應,故實驗
到達平衡所以時間較短,反應速率較快,但平衡時氮氣的濃度不變,改變條件平衡不移動,該反應正反應是氣體體積減小的反應,故實驗![]() 應是使用催化劑,
應是使用催化劑,
由圖可知,與實驗![]() 相比,實驗
相比,實驗![]() 到達平衡所以時間較短,反應速率較快,平衡時氮氣的濃度增大,改變體積平衡向逆反應移動,該反應正反應是體積減小的放熱反應,故為升高溫度;
到達平衡所以時間較短,反應速率較快,平衡時氮氣的濃度增大,改變體積平衡向逆反應移動,該反應正反應是體積減小的放熱反應,故為升高溫度;
故答案為:![]() ;e;c;
;e;c;
![]() 提高廢氣中氮氧化物的轉化率,應改變條件使平衡向正反應移動,
提高廢氣中氮氧化物的轉化率,應改變條件使平衡向正反應移動,
![]() 該反應正反應是放熱反應,升高溫度,平衡向逆反應移動,氮氧化物的轉化率降低,故a錯誤;
該反應正反應是放熱反應,升高溫度,平衡向逆反應移動,氮氧化物的轉化率降低,故a錯誤;
![]() 該反應正反應是體積增大的反應,增大壓強,平衡向逆反應移動,氮氧化物的轉化率降低,故b錯誤;
該反應正反應是體積增大的反應,增大壓強,平衡向逆反應移動,氮氧化物的轉化率降低,故b錯誤;
![]() 增大
增大![]() 的濃度,平衡向正反應移動,氮氧化物的轉化率增大,故c正確;
的濃度,平衡向正反應移動,氮氧化物的轉化率增大,故c正確;
故答案為:c;
![]() 遇水發生水解反應,
遇水發生水解反應,![]() 分子中負價原子結合水電離的氫離子,正價原子結合水電離的去氫根離子,故生成
分子中負價原子結合水電離的氫離子,正價原子結合水電離的去氫根離子,故生成![]() 的同時還得到HClO;反應中
的同時還得到HClO;反應中![]() 中的Cl元素化合價由
中的Cl元素化合價由![]() 價升高為
價升高為![]() 中
中![]() 價,故轉移1mol電子,生成
價,故轉移1mol電子,生成![]() 的物質的量為1mol,質量為
的物質的量為1mol,質量為![]() ,
,
故答案為:HClO;![]() ;
;
![]() 溶液顯中性,所以
溶液顯中性,所以![]() ,溶液的電荷守恒可得:
,溶液的電荷守恒可得:![]() ,故
,故![]() ,氯化銨是強酸弱堿鹽其水溶液呈酸性,要使氯化銨溶液呈中性,則氨水應稍微過量,因為鹽酸和氨水的體積相等,則氨水的物質的量濃度大于鹽酸;溶液中
,氯化銨是強酸弱堿鹽其水溶液呈酸性,要使氯化銨溶液呈中性,則氨水應稍微過量,因為鹽酸和氨水的體積相等,則氨水的物質的量濃度大于鹽酸;溶液中![]() ,
,![]()
![]()
![]() ,c(NH3·H2O)=(
,c(NH3·H2O)=(![]() )mol/L,電離常數只與溫度有關,則此時
)mol/L,電離常數只與溫度有關,則此時![]() 的電離常數Kb=
的電離常數Kb= =
=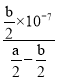 =
=![]() , 故答案為:
, 故答案為:![]() ,
,![]() 。
。


科目:高中化學 來源: 題型:
【題目】參照反應Br + H2 →HBr +H的能量對反應歷程的示意圖,下列敘述中正確的是( )
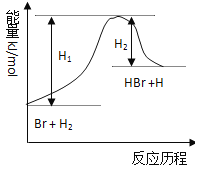
A.正反應為放熱反應
B.加入催化劑,該化學反應的反應熱不改變
C.加入催化劑,該化學反應的活化能不改變
D.加入催化劑可增大正反應速率,降低逆反應速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在化學反應中,如果反應前后元素化合價發生變化,就一定有_______ 轉移,這類反應屬于________ 反應,元素化合價降低,表明該元素的原子______ 電子,含該元素的物質發生________ 反應,這種物質是________ 劑。
(2)A元素基態原子的最外層有3個未成對電子,次外層有2個電子,其元素符號為________________。
(3)B元素的正三價離子的3d亞層為半充滿,則B的元素符號為_____,其基態電子排布式為_________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在某密閉容器中發生反應:2HI(g) ![]() H2(g)+I2(s),若0~15 s內c(HI)由0.1 mol·L-1減小到0.07 mol·L-1,則下列說法正確的是( )
H2(g)+I2(s),若0~15 s內c(HI)由0.1 mol·L-1減小到0.07 mol·L-1,則下列說法正確的是( )
A. 0~15 s內用I2表示的平均反應速率為v(I2)=0.001 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需時間小于10 s
C. 升高溫度正反應速率加快,逆反應速率減慢
D. 減小反應體系的體積,化學反應速率加快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向盛有5 mL 0.01 mol/L的硫氰化鉀溶液的小燒杯中,加入5 mL0.01 mol/L的FeCl3溶液,混合液立即__________。寫出上述反應的離子方程式_____________。向以上溶液中再加0.1 mol/L NaOH溶液至過量,其現象是__________,寫出發生上述現象的反應離子方程式_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示裝置中,X是鐵,Y是石墨電極,a是硫酸鈉溶液,實驗開始前,在U形管的兩邊同時各滴入幾滴酚酞溶液,下列敘述正確的是( )

A. 閉合K1,斷開K2,X極放出H2
B. 閉合K1,斷開K2,Y極為陽極
C. 閉合K2,斷開K1,Y極的電極反應式為O2+2H2O+4e-=4OH-
D. 閉合K2,斷開K1,工作一段時間后,X電極附近溶液顯紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判斷以下3個熱化學方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+ ![]() H2(g)=
H2(g)= ![]() C2H2(g)ΔH2
C2H2(g)ΔH2
③C(s)+ H2(g)= ![]() C2H4(g)ΔH3
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的順序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.配制250mL0.5mol/L的NaOH溶液,所需的儀器有燒杯、玻璃棒、托盤天平、膠頭滴管和_______。定容時俯視觀察刻度線,其結果_______。(填“偏大”、“偏小”、或“不變”)
Ⅱ.實驗室用加熱固體氯化銨和氫氧化鈣的混合物制取氨氣,反應的化學方程式是_______;所制得的氣體中常含有少量雜質氣體,為了得到純凈的氨氣并加以檢驗,請在下列裝置或試劑中,根據要求作出合適選擇,并將對應選擇的裝置編號字母填入表中的空格處:
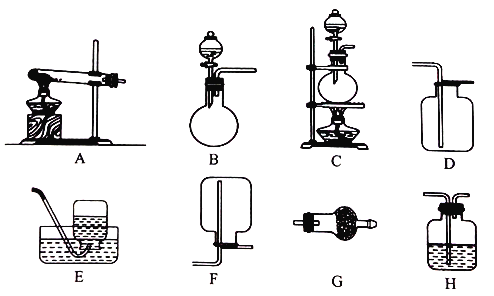
試劑:a. NaOH溶液 b.澄清石灰水 c.濃硫酸 d.飽和NaHCO3溶液 e.堿石灰
f.品紅溶液 g.濕潤的紅色石蕊試紙
制取氣體 | 雜質氣體 | 制取氣體的 發生裝置 | 收集裝置 | 凈化裝置中 所用的試劑 | 檢驗制得的氣體 所用試劑 |
NH3 | H2O(g) | _______ | F | e | _______ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com